Erschließen Sie das Potenzial der Hochaffinitätsreinigung mit Strep-Tactin®XT
Höhere Proteinausbeute mit Strep-Tactin®XT
Mit Strep-tag®II oder Twin-Strep-tag® getaggte Proteine unterschiedlicher Größe wurden mit Strep-Tactin® und Strep-Tactin®XT gereinigt. In allen Beispielen zeigte Strep-Tactin®XT die höchste Bindekapazität (1,6-2x höher als Strep-Tactin®; linke Grafik). In einem weiteren Experiment wurde ein Fab-Fragment, das entweder mit Twin-Strep-tag® oder Strep-tag®II fusioniert war, in einer Konzentration von 0,6 mg/ml zu Zelllysaten gegeben. Die Menge des gereinigten Proteins war für das mit Strep-tag®II fusionierte Fab-Fragment mehr als 3x niedriger, wenn Strep-Tactin® verwendet wurde (rechte Grafik). Dies konnte teilweise durch einen Twin-Strep-tag® ausgeglichen werden, der eine höhere Affinität zu beiden Resins aufweist. Insgesamt führte die Verwendung von Strep-Tactin®XT high capacity zu der höchsten Ausbeute, unabhängig vom Affinitäts-Tag.
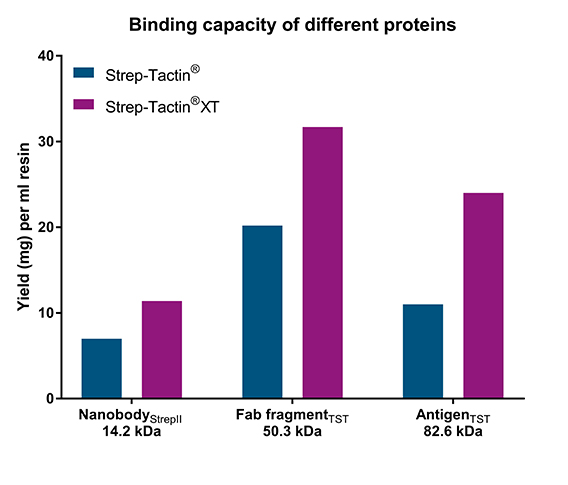
Die maximalen Bindekapazitäten von Strep-Tactin® oder Strep-Tactin®XT high capacity wurden mit Gravity flow-Säulen für drei unterschiedlich große Proteine bestimmt, die entweder an Strep-tag®II oder Twin-Strep-tag® fusioniert sind.
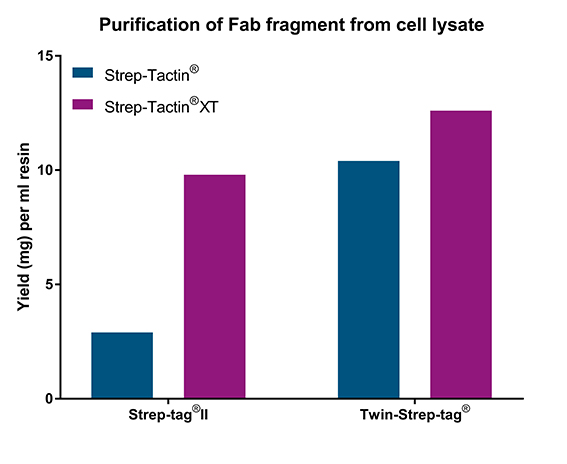
Ein Fab-Fragment, das entweder mit Strep-tag®II oder Twin-Strep-tag® fusioniert ist, wurde Zelllysaten in einer Konzentration von 0,6 mg/ml zugesetzt und anschließend mit Hilfe von Strep-Tactin® oder Strep-Tactin®XT high capacity-FPLC-Säulen gereinigt.
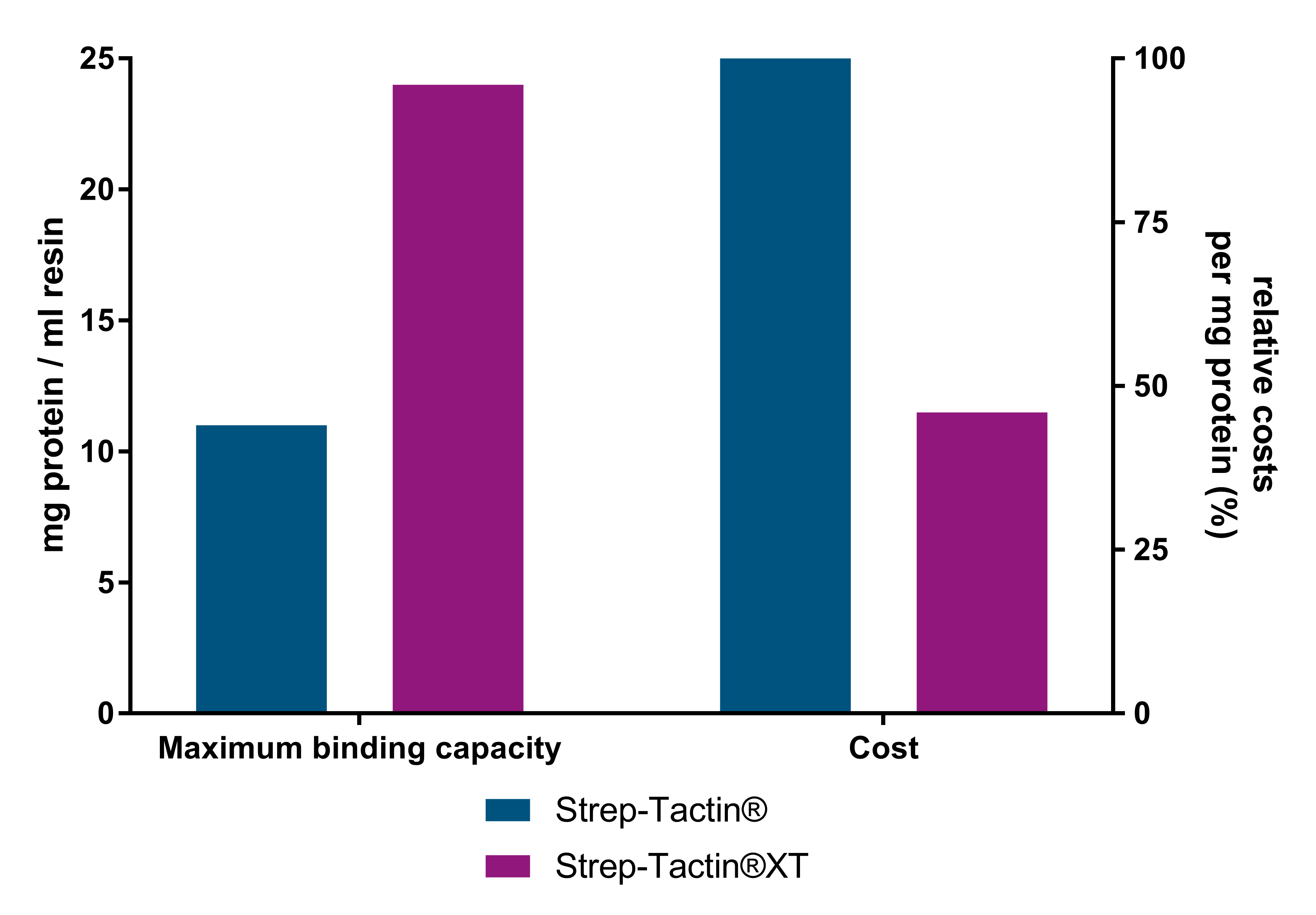
Kostengünstige Proteinreinigung
Strep-Tactin®XT Resins sind aufgrund ihrer höheren Bindekapazität die kostengünstigsten Resins. Im Vergleich zu Strep-Tactin® Resins liefert das Strep-Tactin®XT Resin mehr als das Zweifache an Protein pro ml Resin und kostet bis zu 54 % weniger pro Milligramm gereinigtes Protein. Außerdem verhindert Strep-Tactin®XT das unerwünschte Herausfließen des Zielproteins während der Waschschritte.
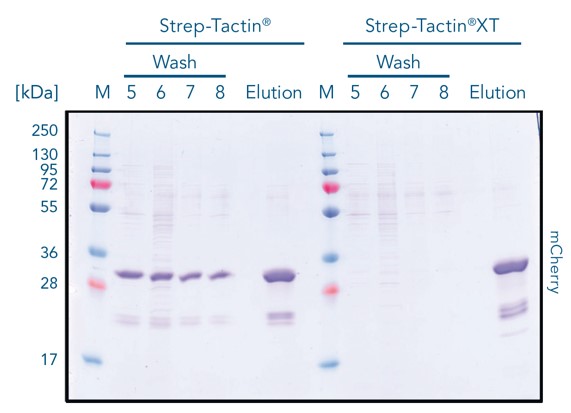
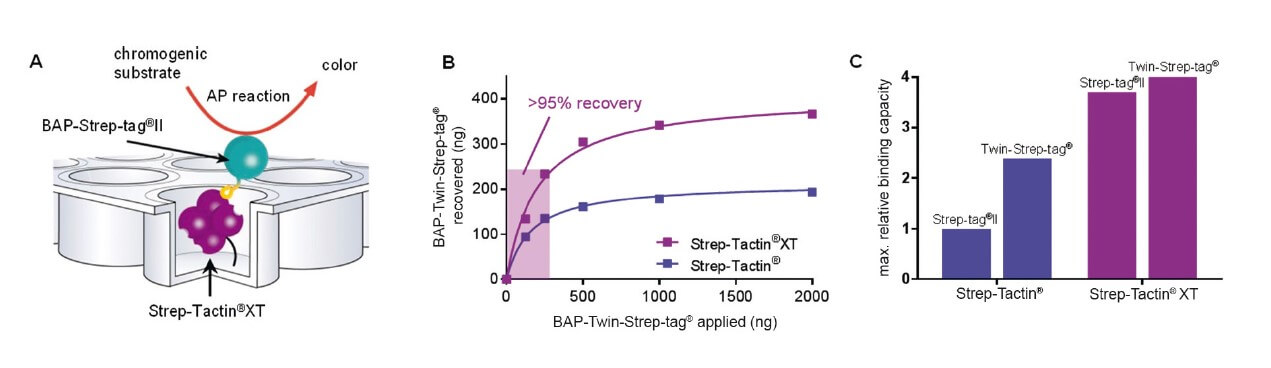
Effizienteste Bindung: Strep-Tactin®XT:Twin-Strep-tag®
Strep-Tactin® und Strep-Tactin®XT wurden mit dem rot fluoreszierenden Protein mCherry beladen, das mit einem Twin-Strep-tag® exprimiert wurde. Strep-Tactin®XT bindet das Protein direkt im oberen Bereich (rechte Spalte), während das Strep-Tactin®-Resin fast das gesamte Resinbett bedeckt (linke Spalte). Die geringere Affinität des Tags zu Strep-Tactin® bewirkt, dass sich das Protein leichter ablöst, was zu einer geringeren Bindekapazität führt, wenn das Protein aus der Säule fließt.

Während der Waschschritte wird das Protein durch Strep-Tactin®XT fest gebunden, und während der Aufreinigung geht kein Protein verloren. Im Gegensatz dazu wird bei Strep-Tactin® Resin ein erheblicher mCherry-Verlust beobachtet. Dieses Ergebnis zeigt, dass Strep-Tactin® Resins nicht mit großen Proben oder Waschvolumina kompatibel sind. In den Reinigungsschritten löst sich das Protein aufgrund der geringeren Affinität ab und läuft von der Säule, wenn das Säulenvolumen erhöht wird.
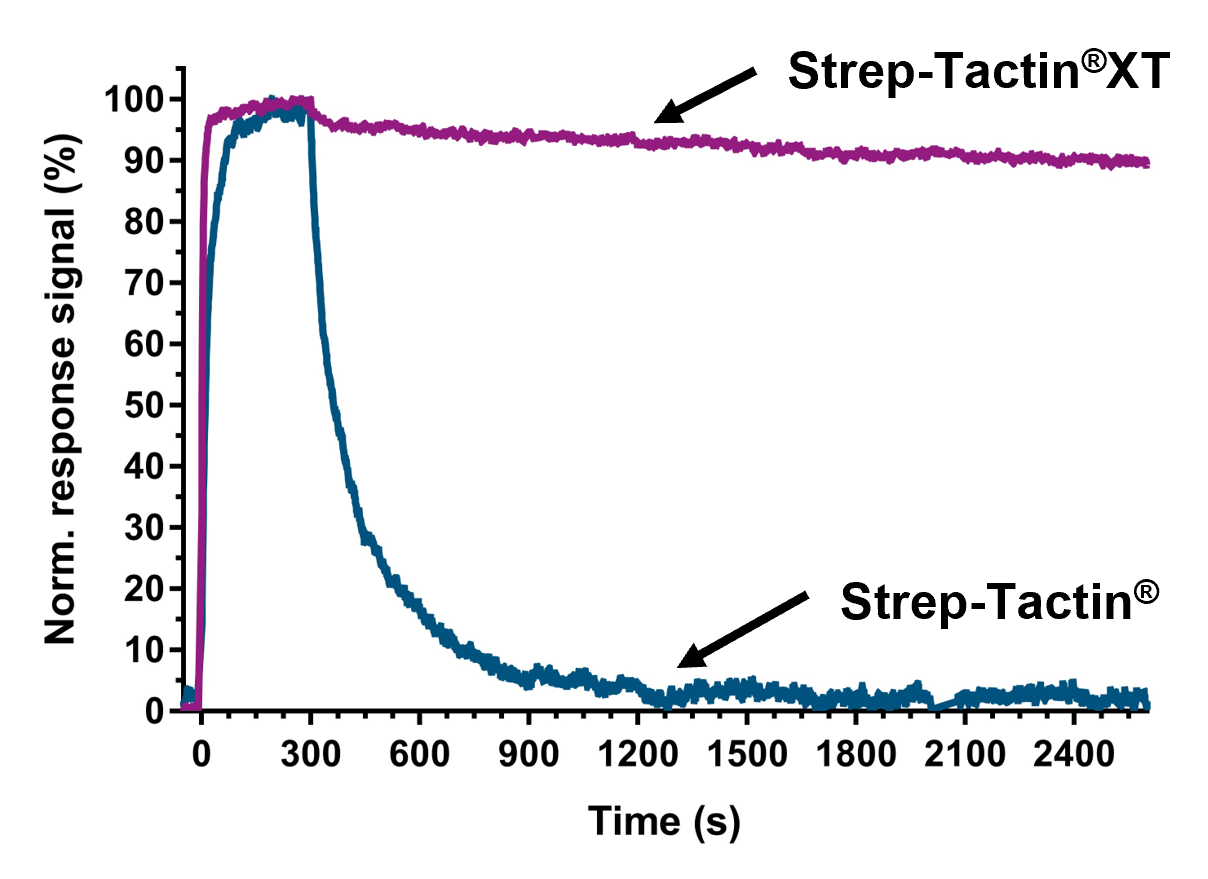
Hohe Affinität von Strep-Tactin®XT ermöglicht SPR-Analyse und BLI
Strep-Tactin®XT kann effizient auf SPR- und BLI-Sensoren immobilisiert werden und ermöglicht das Capturing von TST-fusionierten Liganden mit außergewöhnlich hoher Affinität im pM-Bereich. Das System ermöglicht kinetische Analysen stark bindender Analyten mit langen Dissoziationszeiten und überwindet damit die derzeitigen Einschränkungen anderer auf Affinitäts-Tags basierender Capture-Systeme, wie z. B. His-tags. Die Möglichkeit, verschiedene Liganden sogar direkt aus Kulturmedien einzufangen so wie ein einfaches Regenerationsverfahren der Biosensoren, tragen wesentlich zur Anwendung von Strep-Tactin®XT in optischen Biosensor-Assays bei.
Lesen Sie mehr über die Strep-Tactin®XT-Technologie in Downstream-Anwendungen in dieser Application Note. Erfahren Sie hier auch, warum Twin-Strep-Tag® in Kombination mit Strep-Tactin®XT eine bessere Alternative zum häufig verwendeten Avi-Tag in SPR ist .
Bequeme Assays und Hochdurchsatz-Screenings mit Strep-Tactin®XT
Mit Strep-Tactin®XT beschichtete Mikrotiterplatten ermöglichen komfortable Assays und Hochdurchsatz-Screenings für Strep-getaggte Biomoleküle. Insbesondere die Kombination Twin-Strep-tag®:Strep-Tactin®XT ist mit einer T1/2 von 13 Stunden und einer Affinität im niedrigen pM-Bereich sehr stabil. Die Tag-Ligand-Kombination ist eine effiziente und elegante Option für eine antikörperfreie Immobilisierung von Proteinen.
Darüber hinaus werden die immobilisierten Biomoleküle den Interaktionspartnern auf einheitliche Weise präsentiert , was zu zuverlässigen und hoch reproduzierbaren Assayformaten führt. Dies minimiert die unspezifische Bindung bei minimalen Variationskoeffizienten. Daher sind die Strep-Tactin®XT beschichteten Mikrotiterplatten ein präzises und gleichzeitig kosteneffizientes Werkzeug für Hochdurchsatz-Screenings und diagnostische Assays.
Referenzen für Strep-Tactin®XT
Reinigung von Proteinen
- The adaptive landscape of a metallo-enzyme is shaped by environment-dependent epistasis (Anderson, et al. (2021). Nature)
- CryoEM of RUVBL1–RUVBL2–ZNHIT2, a complex that interacts with pre-mRNA-processing-splicing factor 8 (Serna, et. al.(2022). Nucleic Acids Research)
Hochdurchsatz-Reinigung
- Affinity Purification of TST-Proteins using Strep-Tactin®XT 4Flow® high capacity in IMCStips® (Cook, et al. (2022). Anwendungshinweis)
SPR
- Application of Strep-Tactin®XT for affinity purification of Twin-Strep-tagged CB2, a G protein-coupled cannabinoid receptor (Yeliseev, et al. (2017). Proteinexpression und -aufreinigung)
- A conformation-specific nanobody targeting the nicotinamide mononucleotide-activated state of SARM1 (Hou, et al. (2022). Nature Communications)