Strep-tag® - das führende Affinitätschromatographie-System
Von der Proteinreinigung bis zur Anwendung in der Analytik

Unsere patentierte Strep-tag®-Technologie macht sich eine der stärksten nicht-kovalenten Wechselwirkungen in der Natur zunutze: die Wechselwirkung von Biotin und Streptavidin. Das System basiert auf der hochselektiven und leicht kontrollierbaren Wechselwirkung zwischen dem synthetischen Strep-tag®II-Peptid und dem modifizierten Streptavidin, genannt Strep-Tactin®, welches zu den stabilsten bekannten Proteinen gehört. Das Strep-tag®II-Peptid bindet spezifisch an die modifizierten Streptavidine, Strep-Tactin® und Strep-Tactin®XT, indem es die Bindungstasche des natürlichen Liganden Biotin besetzt. Daher ist die Wechselwirkung durch übermäßige Zugabe des Kompetitors Biotin leicht umkehrbar.
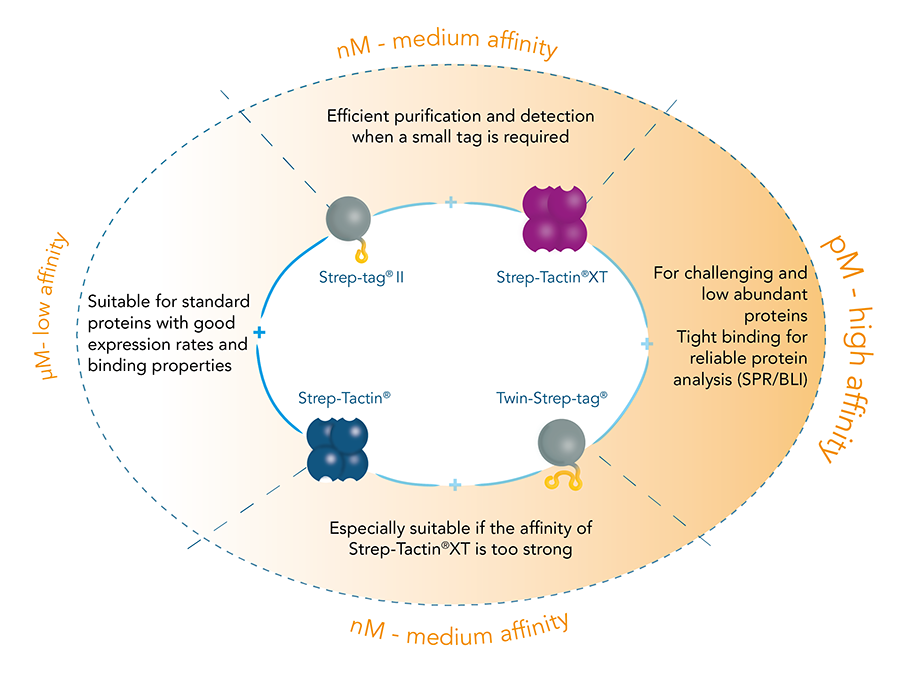
Zwei Affinitäts-Tags - zwei Streptavidin-Derivate: Der Strep-Tag®II besteht aus acht Aminosäuren (Trp-Ser-His-Pro-Gln-Phe-Glu-Lys), während der Twin-Strep-Tag® dieses Motiv zweimal hintereinander, verbunden durch einen Linker, enthält und somit aus 28 Aminosäuren besteht. Beide weisen eine intrinsische, wenn auch ungleiche Affinität zu dem Streptavidin-Derivat Strep-Tactin® und dessen Weiterentwicklung Strep-Tactin®XT auf: Die Bindungsaffinität von Strep-tag®II zu Strep-Tactin® (1µM) ist fast 100-mal höher als zu Streptavidin. Eine weitere Verbesserung wurde durch die Entwicklung von Strep-Tactin®XT erreicht, das eine nM-Affinität zum Strep-tag®II und eine pM-Affinität zum Twin-Strep-tag® hat.
Das Strep-tag® Proteinreinigungssystem umfasst zwei Affinitäts-Tags, den 8 AS Strep-tag®II und seine Tandemversion Twin-Strep-tag®. Beide Versionen können an Strep-Tactin® und dessen hochaffine Variante Strep-Tactin®XT binden. Dabei unterscheiden sich die beiden Tags in den Affinitäten, mit denen sie an Strep-Tactin® und Strep-Tactin®XT binden. Je nach Anwendung und Eigenschaften des zu untersuchenden Proteins kann man die verschiedenen Tags und Strep-Tactin®-Varianten entsprechend der gewünschten Affinität kombinieren.
Aufgrund der unterschiedlichen Bindungsstärke der möglichen Tag-Ligand-Kombinationen hat sich das Strep-tag®-System als universelles Werkzeug für die Isolierung von Proteinen und Zellen etabliert.
- An rekombinante Proteine fusioniert, ermöglicht der Strep-tag® eine effiziente Reinigung in einem Schritt auf immobilisiertem Strep-Tactin®.
- Von Antikörpern abgeleitete Fab-Fragmente oder Nanobodies, die mit dem Twin-Strep-tag® fusioniert sind, können an multimerisiertes Strep-Tactin® binden und ermöglichen so das Einfangen und Freisetzen von Zielzellen auf der Grundlage ihrer Oberflächenmarker oder Antigenspezifität.
- Strep-Tactin® (oder Strep-Tactin®XT) kann seinerseits an Mikrotiterplatten, Fluorophore oder Chips konjugiert werden, was nach der Isolierung des Zielmaterials eine breite Palette von analytischen Anwendungen wie Detektion, Immobilisierung und Interaktionsstudien ermöglicht.


Die wichtigsten Merkmale des Strep-tag®-Systems sind:
- Reversibilität
- Volle Funktionalität des Zielmaterials nach der Isolierung
- Hohe Reinheit
- Universelle Einsetzbarkeit für verschiedene analytische Anwendungen
- Einfache Reinigungsverfahren