Skalierbare Proteinreinigung mit MagStrep® Strep-Tactin®XT Beads
Proteinreinigung
Die Affinitätschromatographie ist ein zentrales Verfahren zur Proteinreinigung, bei dem spezifische Wechselwirkungen zwischen Proteinen und Liganden für eine präzise Isolierung genutzt werden. Unter den verschiedenen Methoden stechen Pull-Down-Assays für die Untersuchung von Protein-Protein-Wechselwirkungen hervor, bei denen die Zielproteine mithilfe eines an einen festen Träger gebundenen Liganden effektiv immobilisiert werden. Für Anwendungen im großen Maßstab gewährleisten Upscaling-Techniken eine effiziente und konsistente Reinigung, die den Anforderungen der Industrie gerecht wird. Im Rahmen der Hochdurchsatzreinigung ermöglichen automatisierte Systeme und optimierte Protokolle die gleichzeitige Verarbeitung zahlreicher Proben, was Forschungs- und Entwicklungsprozesse erheblich beschleunigt. Darüber hinaus bietet die Reinigung mit magnetischen Beads einen vielseitigen und schnellen Ansatz, der sich sowohl für im kleinen als auch für im großen Maßstab angelegte Anwendungen eignet. Entdecken Sie unsere Proteinreinigungsformate, inklusive vorgepackte Gravity flow Säulen, FPLC-Säulen, Resins und magnetischen Beads, die für unterschiedliche Anforderungen geeignet sind.
Die Proteinreinigung mit magnetischen Beads ermöglicht eine effiziente Isolierung von Proteinen insbesondere aus kleinen Probenvolumina oder sogar viskosem Material. MagStrep® Strep-Tactin®XT Beads eignen sich hervorragend für die Batch-Reinigung von Proteinen, da sie sich leicht vom Überstand abtrennen lassen. Die vollständige Entfernung des Probenmaterials während des Magnetic Bead-Reinigungsprozesses in Kombination mit der hohen Spezifität dieser Beads führt zu einer außergewöhnlich hohen Reinheit. Darüber hinaus lässt sich die Reinigung auf der Basis von Magnetic Beads leicht hoch- oder runterskalieren, um unterschiedlichen Probengrößen gerecht zu werden. Ein schnelles Protokoll ermöglicht eine einfache Übertragung auf automatisierte Systeme, was ideal für Screenings mit hohem Durchsatz ist.
Effizienz

Abb. 1. GFP-Twin-Strep-tag-Proben wurden unterschiedlich lange mit magnetischen Beads inkubiert. Eine Inkubationszeit von nur 10 Minuten ist ausreichend, um fast die gesamte Proteinmenge zu reinigen.
Die Reinigung mit magnetischen Beads ist schnell und effizient. Die magnetischen Eigenschaften der Beads ermöglichen eine einfache und schnelle Trennung der Beads vom Überstand mithilfe eines Magneten. Dies reduziert die Verarbeitungszeit und ermöglicht eine schnelle Reinigung von Proteinen.
Abhängig von Ihren experimentellen Bedingungen ist es möglich, das Reinigungsprotokoll zu optimieren und die Proteinausbeute zu erhöhen, indem Sie bestimmte Parameter anpassen. Die folgenden Tipps und Daten helfen Ihnen, die Proteinreinigung mit Magnetbeads zu optimieren, indem Sie Bead-Volumen, Inkubationszeit und Proteinkonzentration anpassen.
Skalierbarkeit

Abb. 2. Die Skalierbarkeit der Proteinreinigung mit MagStrep® Strep-Tactin®XT-Beads wurde durch die Reinigung von αCD45-Nanobodies, die mit einem Twin-Strep-tag® fusioniert sind, aus verschiedenen Probengrößen getestet. Die Hochskalierung der Reinigung führt zu einer steigenden Menge an isoliertem Protein bei gleichbleibender Ausbeute pro ml Lysat.
Automation

Abb. 3. MagStrep-Tactin®XT Beads wurden mit einem Tecan Fluent® getestet. Bei allen Proben wurde eine gleichbleibend hohe Wiederfindung und Reinheit erzielt.
Automatisierte Proteinreinigungssysteme sind schnell und liefern reproduzierbare Ergebnisse und eignen sich daher ideal für Anwendungen mit hohem Durchsatz, z. B. für die Arzneimittelforschung und das Screening.
Effizienz und Reinheit bei der Proteinreinigung mit magnetischen Beads
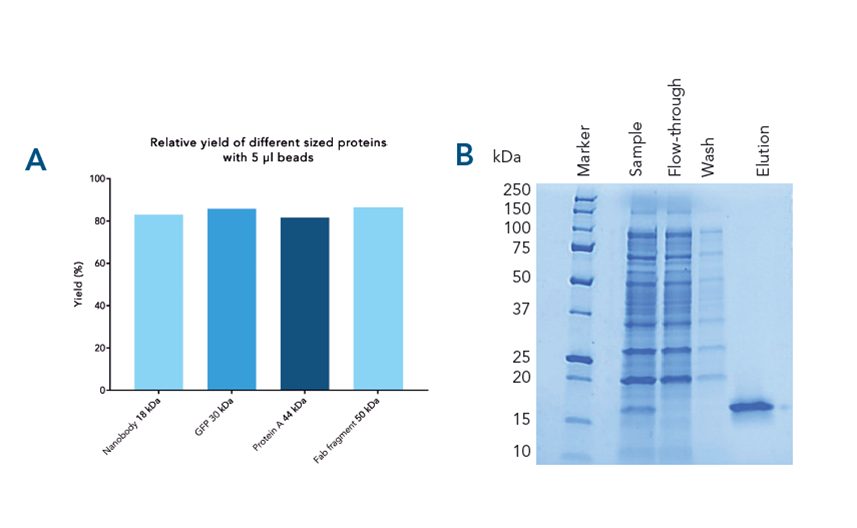
Spezifisches Capture, hohe Ausbeute und Reinheit des Zielproteins. Verschiedene Proteine wurden aus gespiktem E. coli-Lysat mit hoher Ausbeute (> 82 %) gereinigt (A). Spezifisches Binden und Reinheit sind am Beispiel des mit dem Twin-Strep-tag® fusionierten αCD45-Nanobodies dargestellt (B).

Zeitsparende Proteinreinigung. GFP-Twin-Strep-tag-Proben wurden unterschiedlich lange mit magnetischen Beads inkubiert. Eine Inkubationszeit von nur 10 Minuten reicht aus, um fast die gesamte Proteinmenge zu reinigen.
Einfache skalierbare Proteinreinigung auf der Basis von magnetischen Beads mit Wiederverwendungsmöglichkeit
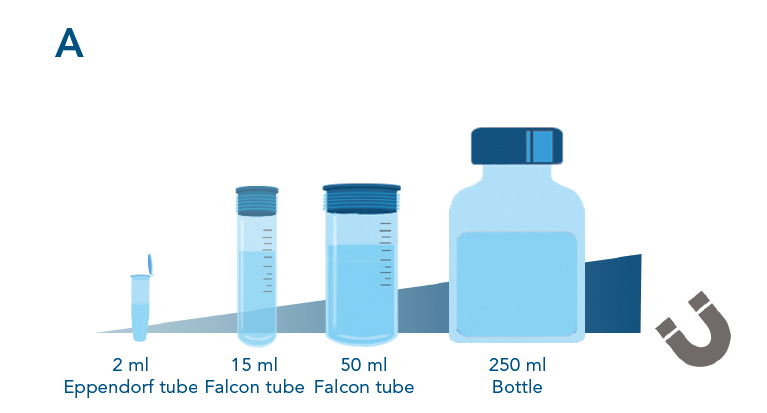
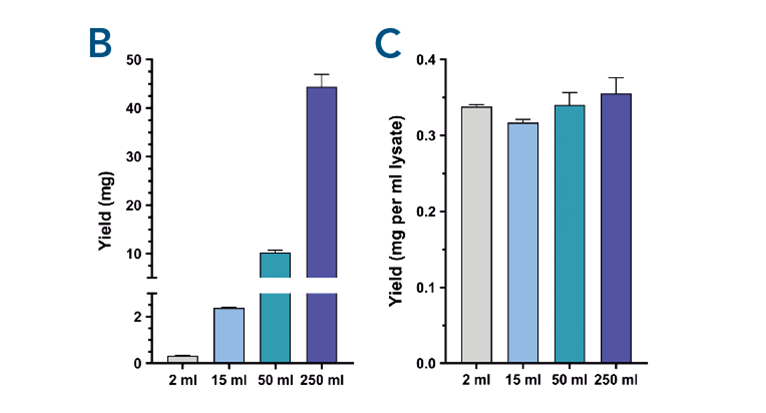
Einfache Skalierbarkeit des Reinigungsprozesses. Die Skalierbarkeit der Proteinreinigung mit MagStrep® Strep-Tactin®XT-Beads wurde durch die Reinigung von αCD45-Nanobodies, die mit einem Twin-Strep-tag® fusioniert sind, aus unterschiedlich großen Proben getestet. Die Auftrennung erfolgte mit einem biomagnetischen SepMag® A200ml-Separator (A). Die Skalierung der Reinigung führt zu einer zunehmenden Menge an isoliertem Protein (B) bei gleichbleibender Ausbeute pro ml Lysat (C).
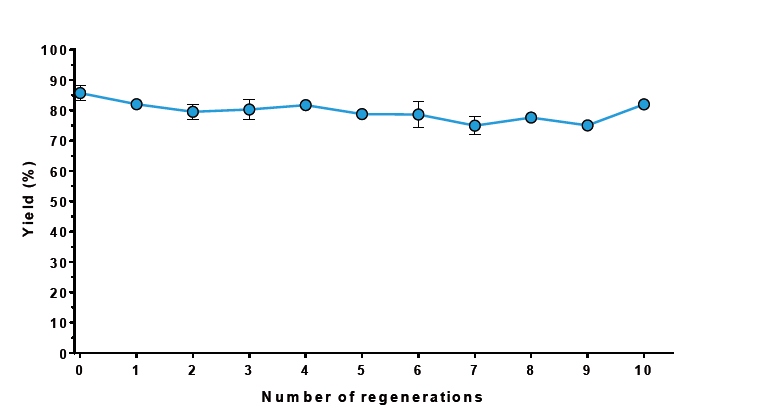
Schnelle und einfache Regeneration. Nach jeder Reinigung wurden die MagStrep® Strep-Tactin®XT Beads mit 0,1 M NaOH für 2 min regeneriert. Die Proteinbindekapazität blieb für mindestens 10 Regenerationszyklen stabil, was besonders bei Anwendungen im großen Maßstab Kosten spart.
Hochdurchsatz-Screening und Automatisierung mit MagStrep® Strep-Tactin®XT Beads
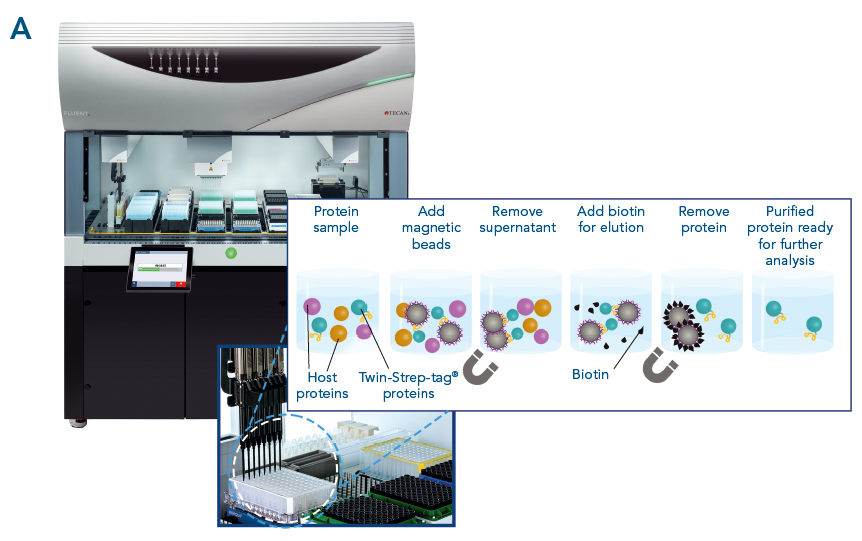
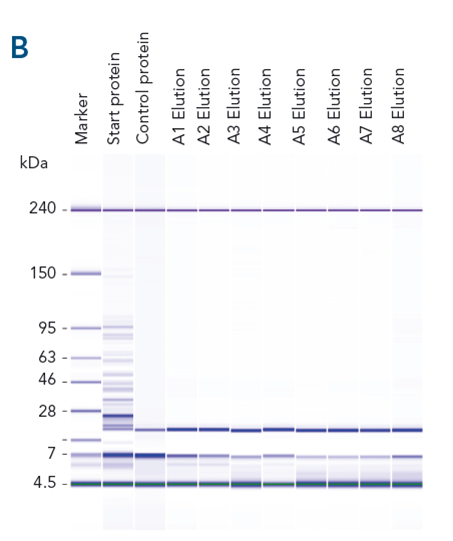
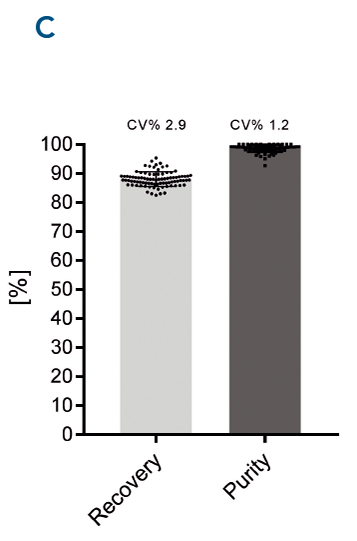
Automatisierte Proteinreinigung mit hoher Wiederfindung und Reinheit. Automatisierung und parallele Proteinreinigung mit MagStrep® MagStrep-Tactin®XT-Beads wurden mit einem Tecan Fluent® getestet (A). αCD45-Nanobody, fusioniert mit einem Twin-Strep-tag®, wurde parallel aus 88 Proben gereinigt. Die Reinheit wurde mit dem Bioanalyzer auf einem Protein 230 Chip analysiert (B). Für alle Proben wurde eine gleichbleibend hohe Wiederfindung und Reinheit erzielt (C).
Referenzen für mögliche Anwendungen mit magnetischen Beads
Reinigung im kleinen Maßstab:
"GPCR Solubilization and Quality Control. Expression, Purification, and Structural Biology of Membrane Proteins." (Miljus, T., et al. (2020).)
Die Solubilisierung von G-Protein-gekoppelten Rezeptoren (GPCRs) ist aufgrund ihrer hydrophoben Natur und Instabilität in wässrigen Lösungen eine Herausforderung. Miljus et al. skizzieren Methoden zur Extraktion von GPCRs mit Hilfe von Detergenzien und zur anschließenden Bewertung der Qualität und Funktionalität der solubilisierten Proteine. Für die effektive Reinigung von GPCRs in kleinem Maßstab beschreiben Miljus et al. ein einfaches Verfahren unter Verwendung von Strep-Tactin®XT beschichteten magnetischen Beads in Kombination mit dem Twin-Strep-tag®.
Affinitätsreinigung gekoppelt mit Massenspektroskopie (AP/MS):
"A comprehensive proteomics analysis of JC virus Agnoprotein-interacting proteins: Agnoprotein primarily targets the host proteins with coiled-coil motifs." (Saribas, A. S., et al. (2020).)
Die Arbeit konzentriert sich auf das Agnoprotein des JC-Virus (JCV) und seine Rolle im Replikationszyklus des Virus. Das Agnoprotein, das als entscheidend für die JCV-Replikation identifiziert wurde, interagiert mit 501 zellulären Wirtsproteinen, was mithilfe des Strep-tag®-Affinitätsreinigungssystems und der Massenspektroskopie (AP/MS) untersucht wurde. Diese Wechselwirkungen erstrecken sich über mehrere zelluläre Netzwerke, die an der Proteinsynthese, dem Proteinabbau und dem zellulären Transport beteiligt sind. Die Interaktionslandschaft erstreckt sich auf Organellen wie Mitochondrien, den Zellkern und das ER-Golgi-Netzwerk. Saribas et al. bevorzugten den Strep-getaggt gegenüber dem Flag-tag und dem His-tag aufgrund seiner hohen Spezifität und Affinität, der milden Reinigungsbedingungen, der biologischen Inertheit und Stabilität sowie der hohen Reinheit, die bei hochempfindlichen Anwendungen wie der Proteomik entscheidend ist.
Automatisierung:
"A SARS-CoV-2 protein interaction map reveals targets for drug repurposing." (Gordon, D. E., et al. (2020).)
Gordon et al. identifizierten die menschlichen Proteine, die mit viralen Proteinen von SARS-CoV-2 assoziiert sind, mit Hilfe eines Affinitätsreinigungs-Massenspektrometrie-Ansatzes (AP-MS). Dazu exprimierten sie Twin-Strep-getaggte Versionen von SARS-CoV-2-Proteinen in menschlichen Zellen, was sie durch Anti-Strep-Westernblot nachweisen konnten. Anschließend reinigten Gordon und Kollegen die exprimierten Twin-Strep-getaggten viralen Proteine zusammen mit den assoziierten humanen Proteinen unter Verwendung des Vorgängers der MagStrep® Strep-Tactin®XT-Beads in Kombination mit dem KingFisher Flex Purification System, einem automatischen Extraktionsinstrument. Mit diesem Hochdurchsatzverfahren wurden 332 menschliche Proteine identifiziert, die mit hoher Wahrscheinlichkeit mit Virusproteinen interagieren, was für die Entwicklung neuer Medikamente gegen COVID-19 unerlässlich ist.