Entwicklung und Herstellung monoklonaler Antikörper
Die Identifizierung und Herstellung von monoklonalen Antikörpern ist für die Untersuchung von Immunreaktionen und die Entwicklung von Therapien essenziell. Darüber hinaus können sie für den direkten und indirekten Nachweis von Antigenen in verschiedenen Assays, als auf Mikrotiterplatten immobilisiertes Bindungsmolekül oder als Liganden für die Proteinreinigung eingesetzt werden, was sie zu einem vielseitigen Werkzeug in der Biotechnologie macht.
Für die Entdeckung monoklonaler Antikörper wurden verschiedene Methoden entwickelt, darunter die Hybridomtechnologie, das Phagen-Display oder die Sortierung einzelner B-Zellen.
Ihr gemeinsames Ziel ist die Identifizierung von Antikörpern mit hoher Affinität, die ein bestimmtes Antigen erkennen. Dies macht das Antigen zu einer zentralen Komponente bei der Antikörperentwicklung. Die Fusion eines Twin-Strep-tag® an ein Antigen ermöglicht, diese zentrale Komponente für verschiedene Schritte im Entwicklungsprozess nutzbar zu machen.
Der Twin-Strep-tag® ist geeignet für:
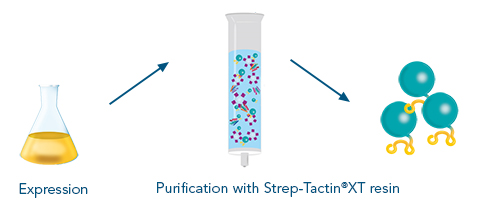
- Reinigung und Analyse von Antigenen (Proteinen)
- Immunisierung
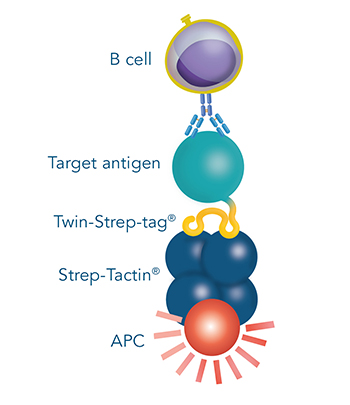
- Antigen-spezifische B-Zell-Färbung und Isolierung mittels FACS
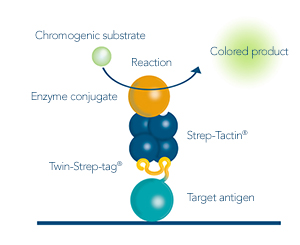
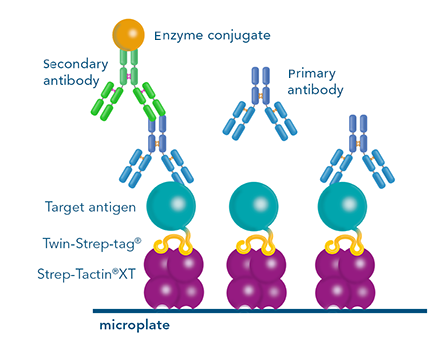
- ELISA und Western Blot
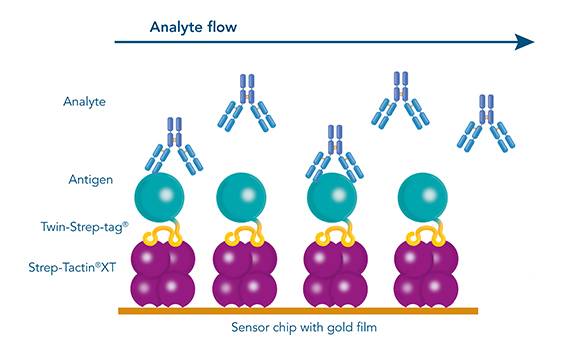
- Biosensor-Anwendungen
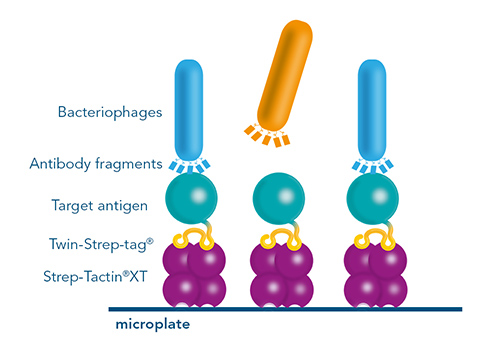
- Biopanning
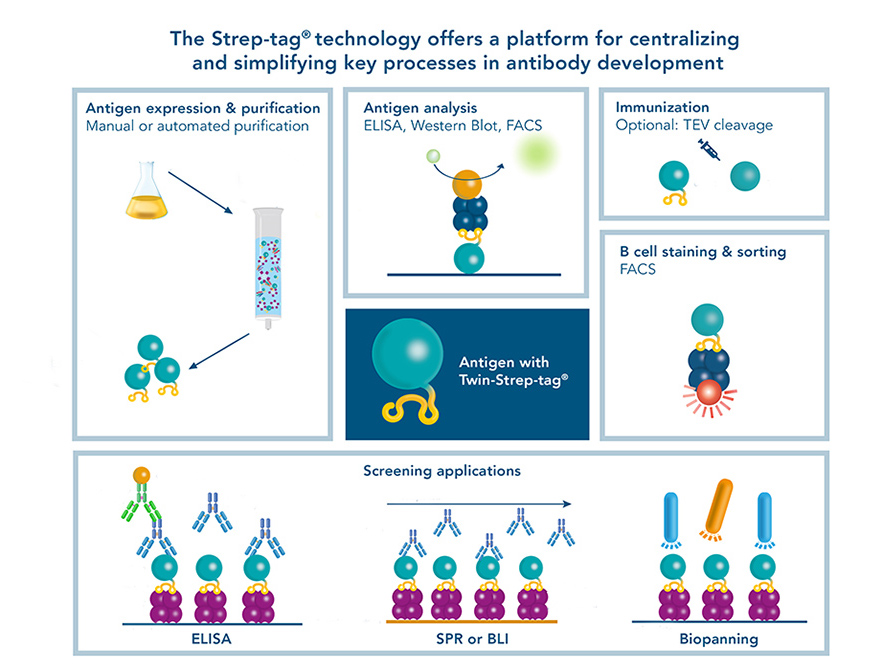
Abbildung 1: Ein mit einem Twin-Strep-tag® fusioniertes Antigen als zentrale Komponente für alle Anwendungen, die in der Antikörperentwicklung (z. B. mittels Hybridomtechnologie, Single-B-Zell-Sortierung oder Phagen-Display) benötigt werden