Wie lassen sich häufige Probleme im Zusammenhang mit dem His-tag-System umgehen?
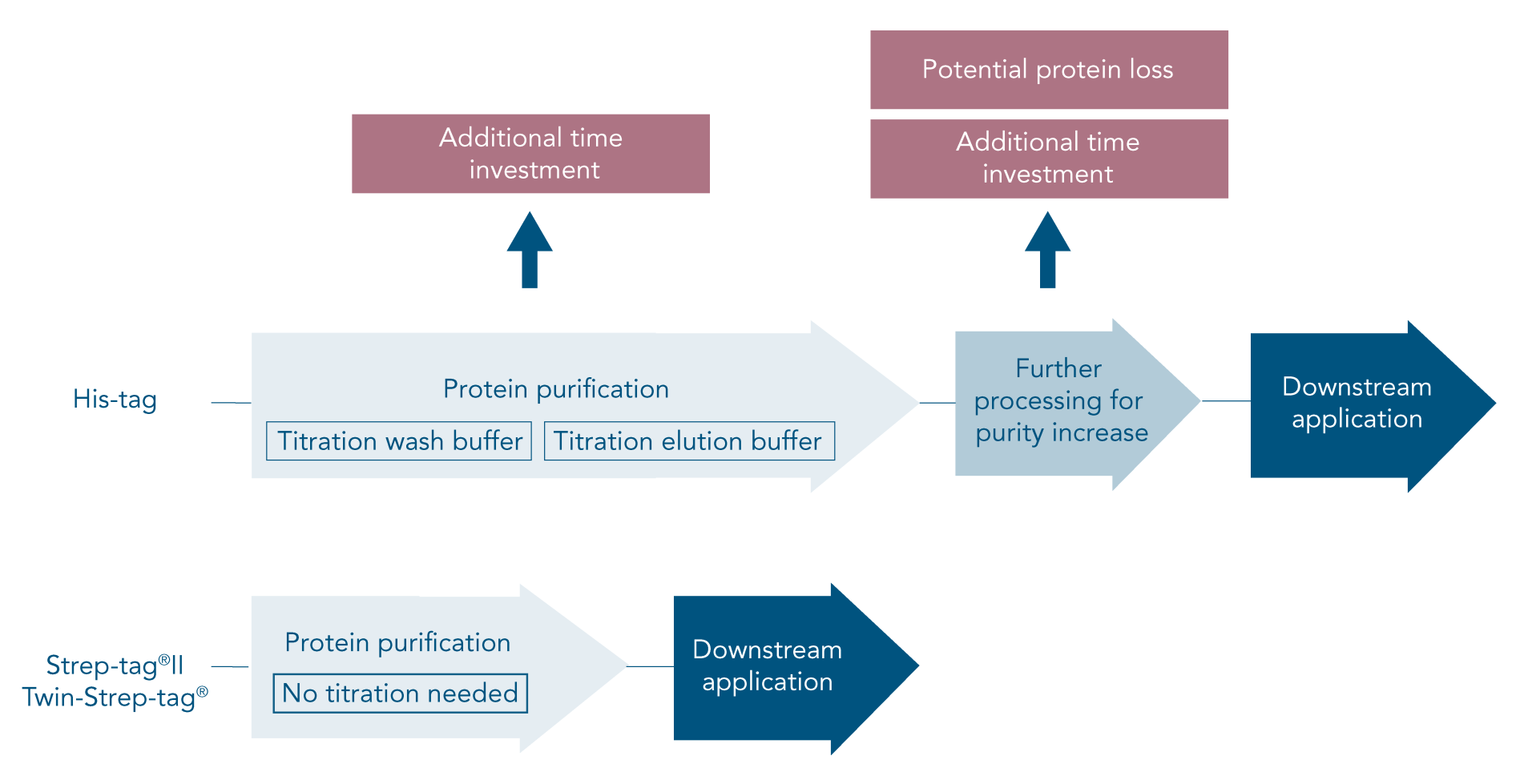
Der His-tag (6xHis-tag, His6-tag oder Polyhistin-tag) ist ein beliebter Affinitäts-Tag für die Proteinreinigung, da seine geringe Größe eine geringe Auswirkung auf die Proteinstruktur gewährleistet. Während das His-tag-System wegen seiner hohen Ausbeute und niedrigen Kosten beliebt ist, wird der Zeit- und Arbeitsaufwand für eine erfolgreiche His-tag-Reinigung oft nicht berücksichtigt.
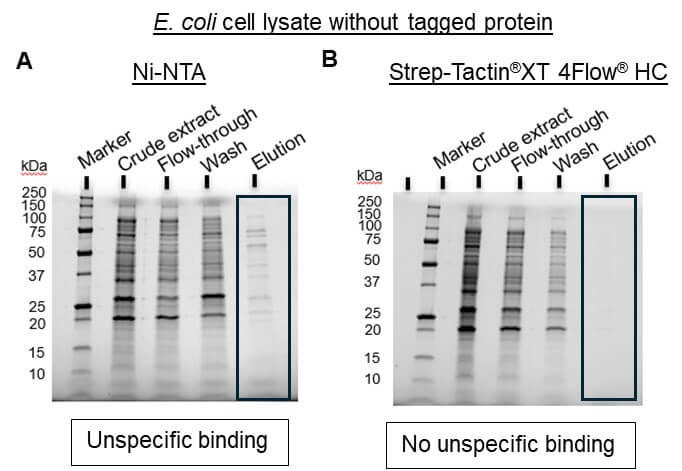
- Geringe Proteinreinheit aufgrund unspezifischer Bindung von Wirtsproteinen (Abbildung 1A)
- Proben- oder Pufferkomponenten stören die Proteinbindung
- Proteinausfällung nach der Reinigung aufgrund von inkompatiblen Pufferkomponenten
- Kulturmedien für Säugetierzellen stören die Proteinbindung oder verursachen Ni2+-Leakage
- Der für das Zielprotein erforderliche pH-Wert führt zur Elution aus der Ni-NTA-Agarose
- Eingeschränkte Anwendbarkeit in der Proteinanalyse aufgrund geringer Tag-Liganden-Affinität und -Spezifität
Um diese Probleme zu vermeiden oder zu lösen, ist eine sorgfältige Planung des Verfahrens und eine Optimierung des His-tag-Reinigungsprotokolls erforderlich. Schließlich kann es vorkommen, dass ein His-tag immer noch keine zufriedenstellenden Ergebnisse liefert oder für eine bestimmte Art von Protein überhaupt nicht geeignet ist. In diesem Fall sollte ein anderer Affinitäts-Tag in Betracht gezogen werden.
Das Strep-tag®-System ist die ideale Alternative zum His-tag, da alle üblichen Probleme vermieden werden. Aufgrund der spezifischen Tag-Ligand-Interaktion führt die Proteinisolierung mit diesem System zu hochreinem Protein ohne weitere Optimierungs- oder Verarbeitungsschritte (Abbildung 1B).
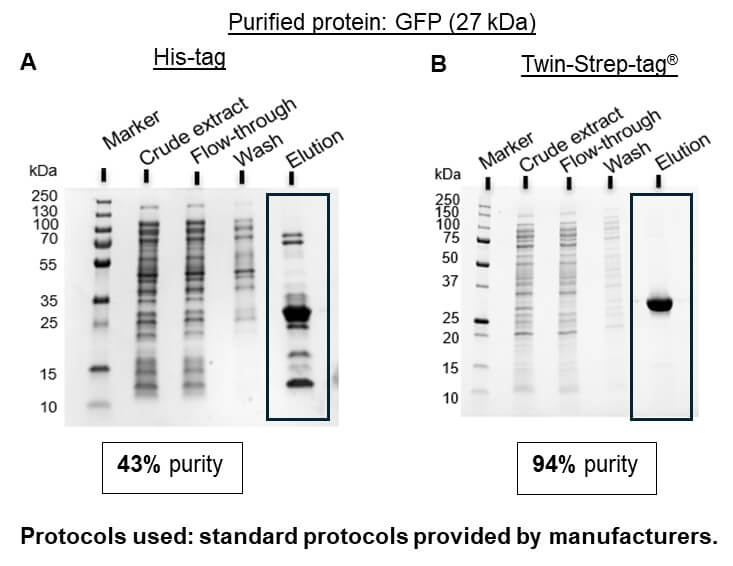
Abbildung 1: GFP, das entweder an einen 6xHis-tag (A) oder an einen Twin-Strep-tag® (B) fusioniert ist, wurde aus E. coli-Lysaten isoliert, wobei die Standardprotokolle der Hersteller der verwendeten Resins (Ni-NTA von Thermo Fisher Scientific für His-tag und Strep-Tactin®XT 4Flow® high capacity von IBA Lifesciences für Twin-Strep-tag®) verwendet wurden.
Sehen Sie sich unser kostenloses On-Demand-Webinar über häufige Probleme bei der His-tag-Reinigung an und lesen Sie unser Whitepaper, das His-tag- und Strep-tag®-Proteinreinigungssysteme vergleicht.