Kostensparende Proteinforschung durch einfache & effiziente Regeneration von Strep-Tactin® und Strep-Tactin®XT
Die Möglichkeit, Reinigungs- oder Immobilisierungsprodukte wiederzuverwenden, spart sowohl Zeit als auch Kosten, da sie nicht so häufig ausgetauscht werden müssen. Dieser Vorteil erstreckt sich auf eine Reihe von Anwendungen, darunter Affinitätschromatographie, magnetische Batch-Reinigung und SPR/BLI. Um eine effektive Wiederverwendung ohne Verlust der Bindekapazität zu ermöglichen, ist ein Regenerationsverfahren erforderlich, das effizient ist, aber den bindenden Liganden und sein Trägermaterial nicht schädigt. Aufgrund ihrer Bindungseigenschaften und ihrer hohen Stabilität eignen sich Strep-Tactin® und Strep-Tactin®XT, die an magnetische oder nicht-magnetische Agarosebeads oder an Biosensorchips gekoppelt sind, hervorragend für mehrere Regenerationszyklen und sogar Clean-in-Place (CIP)-Verfahren.
Regenerierung von Affinitätschromatographie-Resins
Strep-Tactin® und Strep-Tactin®XT Affinitätschromatographie-Resins lassen sich leicht mit 100 mM Natriumhydroxid (NaOH) regenerieren. Es handelt sich um ein einfaches Verfahren, bei dem der Regenerationspuffer direkt nach dem letzten Proteinelutionsschritt angewendet wird. Nach dem Waschen der Säule kann diese sofort für weitere Aufreinigungsschritte verwendet oder für eine spätere Verwendung gelagert werden (Abb. 1). Da die Liganden (Strep-Tactin® & Strep-Tactin®XT) stabil an die Agarose-Beads gekoppelt sind, können die Resins 50 Mal* regeneriert werden, ohne ihre Bindekapazität zu verlieren (Abb. 2). Für Strep-Tactin®XT-Resins bietet IBA Lifesciences auch einen gebrauchsfertigen Regenerationspuffer (Buffer XT-R) mit 3 M MgCl2 an, der ebenso effektiv wie 100 mM NaOH verwendet werden kann (Abb. 2 rechts).
*Die Angaben können je nach Proteineigenschaften und erforderlichen Pufferkomponenten variieren.
Abbildung 1: Schnelles und einfaches Regenerationsprinzip für Strep-Tactin® & Strep-Tactin®XT Resins. Nach der Elution des gebundenen Proteins kann 100 mM NaOH zur Regeneration eingesetzt werden. Nach dem Waschen mit Buffer W ist das Resin für einen weiteren Reinigungszyklus oder zur Lagerung bereit.
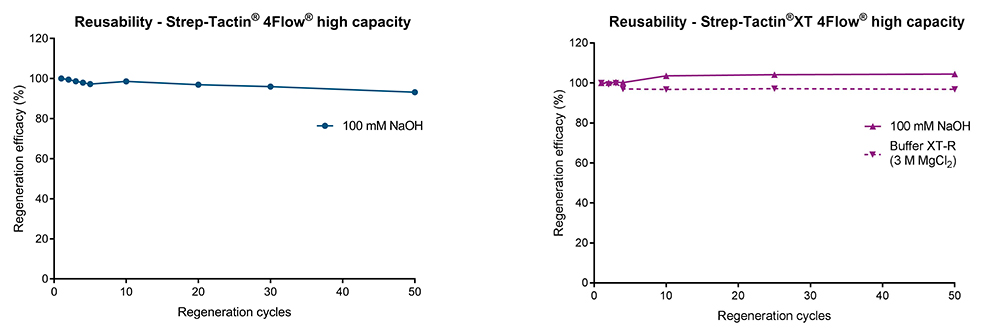
Abbildung 2: (links) Strep-Tactin® und (rechts) Strep-Tactin®XT Affinitätschromatographie-Resins können 50 Mal mit 100 mM NaOH regeneriert werden, ohne dass die Bindekapazität verloren geht. Für Strep-Tactin®XT wird ein gebrauchsfertiger Regenerationspuffer (Buffer XT-R) angeboten, der 3 M MgCl2 enthält und einfach zu verwenden ist.
Clean-in-place (CIP)
Bei Bioprozessanwendungen ist es nicht nur wichtig, dass ein Affinitätschromatographie-Resin mehrfach wiederverwendet werden kann, um die Kosten zu senken, sondern auch, dass es effizient gereinigt werden kann, um Säulenverschmutzung zu vermeiden. Verunreinigungen müssen entfernt werden, um eine Kontamination der Proben und eine Verschlechterung der Säulenleistung zu vermeiden. Ein Standardreinigungsmittel in der Bioproduktion ist NaOH. Eine ausreichend hohe Konzentration von NaOH entfernt z. B. Proteine, Lipide, Nukleinsäuren und Bakterien. Während Strep-Tactin® und Strep-Tactin®XT Resins bei 100 mM NaOH sehr stabil sind (Abb. 2), können sie auch mindestens 10 Mal 500 mM NaOH ausgesetzt werden, ohne dass die Leistung des Resins beeinträchtigt wird (Abb. 3). Selbst nach 50 Zyklen ist nur ein geringer Verlust der Bindekapazität zu beobachten, was die Eignung von Strep-Tactin® und Strep-Tactin®XT für CIP-Verfahren belegt.
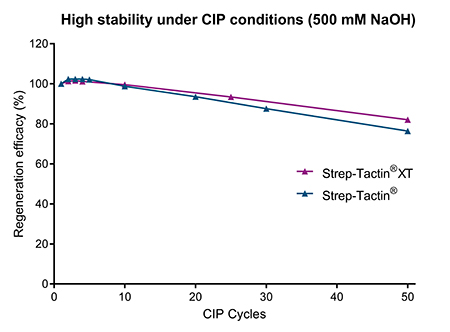
Abbildung 3: Sowohl Strep-Tactin® als auch Strep-Tactin®XT-Resins können während mehrerer CIP-Zyklen 500 mM NaOH ausgesetzt werden, ohne dass es zu einem signifikanten Verlust der Bindekapazität kommt.
Regeneration von magnetischen Beads
Eine Alternative zur Proteinreinigung mittels Affinitätschromatographie ist die Batch-Reinigung mit magnetischen Beads. Magnetische Beads sind besonders beliebt für Anwendungen im kleinen Maßstab und mit hohem Durchsatz. Allerdings ist auch ein Upscaling möglich, was die Möglichkeit der Regeneration wichtig für einen kosteneffizienten Einsatz macht. MagStrep® Strep-Tactin®XT Beads sind agarosebeschichtete Magnetbeads, die mindestens 10 Mal wiederverwendet werden können, wenn sie nach jeder Aufreinigung mit 100 mM NaOH regeneriert werden (Abb. 4). Ähnlich wie bei den Affinitätschromatographie-Resins ist das Regenerationsverfahren einfach und unkompliziert und erfordert nur zwei grundlegende Schritte: Inkubation mit NaOH und anschließendes Waschen.
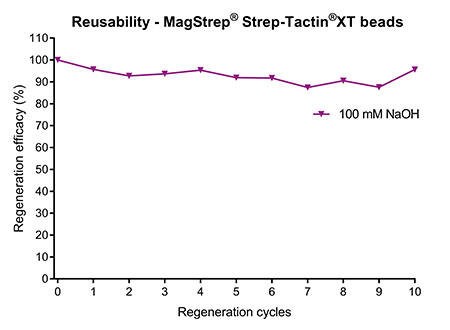
Abbildung 4: MagStrep® Strep-Tactin®XT Beads wurden nach der Proteinreinigung mit 100 mM NaOH regeneriert. Die Bindekapazität blieb über mindestens 10 Regenerationszyklen stabil.
Regeneration von SPR-Chips
Die Eigenschaften von Strep-Tactin®XT ermöglichen nicht nur eine effiziente Regeneration bei Proteinreinigungsverfahren, sondern auch bei analytischen Anwendungen wie SPR oder BLI. Für kinetische Messungen wird Strep-Tactin®XT auf Biosensoren immobilisiert. Nach dem Einfangen eines Strep-getaggten Liganden und der Messung der Bindungskinetik eines Analyten werden durch Zugabe von 3 M Guanidin-Salzsäure (GuHCl) alle Ligand-Analyt-Komplexe effizient entfernt. Nachdem GuHCl mit einem geeigneten Laufpuffer abgewaschen wurde, kann eine weitere Probe analysiert oder der Biosensor bis zur weiteren Verwendung gelagert werden (Abb. 5 links). Mit diesem einfachen Verfahren können die mit Strep-Tactin®XT beschichteten Chips mindestens 30 Mal wiederverwendet werden, ohne dass sich dies negativ auf das Detektionsniveau des Liganden auswirkt (Abb. 5 rechts). Neben der Kostenersparnis ist diese Möglichkeit der einfachen Regeneration sehr praktisch für die Messung mehrerer Proben hintereinander, da Strep-Tactin®XT nach jedem Zyklus stabil an den Biosensor gebunden bleibt.
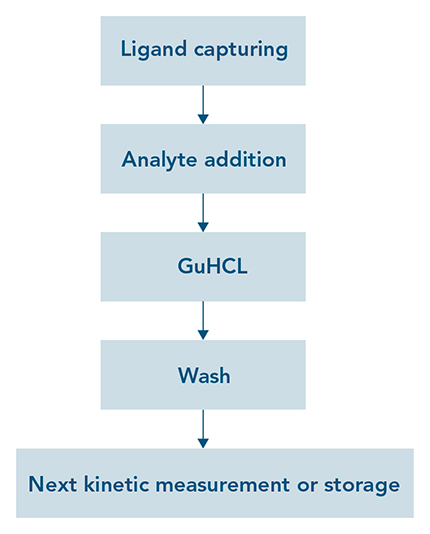
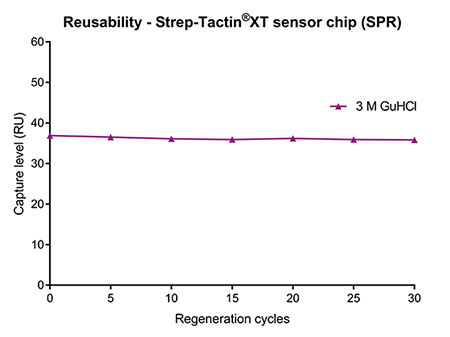
Abbildung 5: (links) Strep-Tactin®XT auf Biosensoren ermöglicht ein einfaches und unkompliziertes Regenerationsverfahren für analytische Anwendungen wie SPR und BLI. (rechts) Ein Strep-Tactin®XT-Sensorchip wurde nach jeder Messung mit 3 M GuHCl regeneriert. Das Detektionsniveau eines Twin-Strep-getaggten Proteinliganden blieb über mindestens 30 Regenerationszyklen stabil.

