Zuverlässige Pull-down-Assays mit MagStrep® Strep-Tactin®XT-Beads
Zu wissen, welche Proteine miteinander interagieren, ist ein wichtiger Schritt, um Signalwege und spezifische Proteinfunktionen zu verstehen und ein entscheidender Punkt, um die Mechanismen von Krankheiten zu entschlüsseln und neue Zielproteine für die Entwicklung von Medikamenten zu identifizieren. Für die Untersuchung von Protein-Protein-Interaktionen sind Pull-Down-Assays zu einem unschätzbaren Werkzeug für Wissenschaftler geworden. Bei Pull-Down-Assays werden Wechselwirkungen zwischen zwei oder mehr Proteinen nachgewiesen. Dabei wird entweder die vorhergesagte Protein-Protein-Interaktion bestätigt oder es werden neue Wechselwirkungen entdeckt. Pull-down-Ansätze sind bequeme und kostengünstige In-vitro Techniken, bei denen das Bait-Protein mit einem Affinitäts-Tag wie dem Twin-Strep-tag® fusioniert und auf Beads immobilisiert wird, die an den entsprechenden Liganden, z. B. Strep-Tactin®XT, gekoppelt sind. Anschließend wird eine Probe die vermutliche Prey-Proteine enthält aufgetragen. Alternativ können Zelllysate, die das markierte Bait-Protein und seine potenziellen Interaktionspartner enthalten, direkt auf das Resin gegeben werden. In beiden Fällen werden die gebildeten Bait-Prey-Komplexe mit chemischen oder biologischen Reagenzien eluiert, wodurch der Tag vom Liganden gelöst wird.
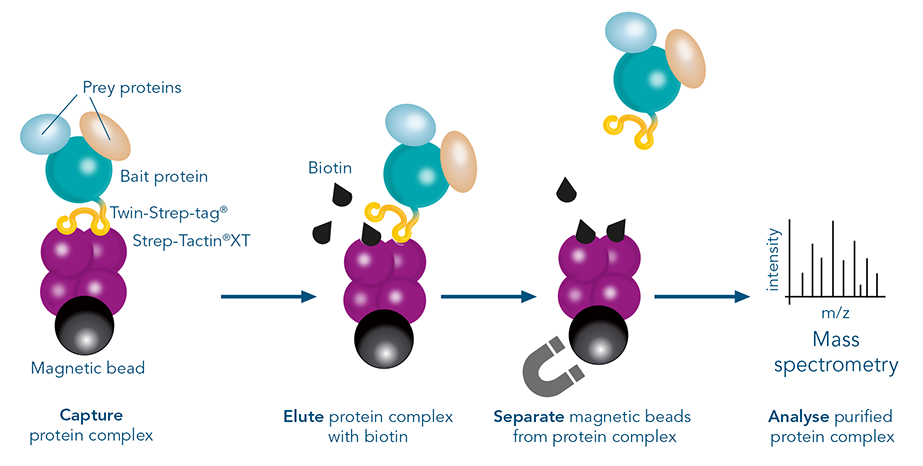
Bei Pull-down-Assays werden die Interaktionspartner während der Aufreinigung zusammen mit dem markierten Protein "heruntergezogen". Bestehende Proteininteraktionen bleiben während der sanften Waschschritte erhalten. In der resultierenden Elution sind sowohl das Zielprotein als auch seine Interaktionspartner vorhanden. Welche Proteine interagiert haben, kann durch weitere Analysen, z. B. in der Massenspektrometrie, ermittelt werden.
MagStrep® Strep-Tactin®XT-Beads binden an Bait-Proteine, die mit Twin-Strep-tag® markiert sind, mit einer picomolaren Affinität, die Bindung is jedoch reversibel und ermöglicht eine milden Elutionsprozess. Die spezifische Bindung des Twin-Strep-tags® an Strep-Tactin®XT bildet die Grundlage für eine effiziente Aufreinigung von markierten Bait-Prey-Komplexen in vitro. Darüber hinaus ist der Twin-Strep-tag® klein und chemisch inert, wodurch er weder die ordnungsgemäße Proteinfaltung und -funktion noch die Bindungsinteraktionen in Komplexen beeinträchtigt. Milde und anpassbare Waschbedingungen sorgen dafür, dass die Proteinkomplexe intakt bleiben. Ein weiterer Vorteil ist die milde Elution, da keine pH-Verschiebung oder schädlichen Stoffe erforderlich sind. Durch die Zugabe von Biotin werden Bait-Prey-Komplexe spezifisch eluiert, was die Co-Reinigung von falsch-positiven Ergebnissen auf nahezu Null reduziert. Diese Eigenschaften unterscheiden den Twin-Strep-tag® von anderen Protein-Tags, die üblicherweise für Pull-down-Assays verwendet werden, wie z. B. FLAG-tag, HA-tag oder Myc-tag. Diese Epitop-tags garantieren eine effiziente Immobilisierung aufgrund einer Antikörper-vermittelten Bindung. Antikörper können jedoch auch unspezifische Proteine mit Sequenzähnlichkeit binden, was zu falsch-positiven Ergebnissen führt. Um eine spezifische Elution von epitopmarkierten Proteinen zu erreichen, werden Peptide in hohen Konzentrationen verwendet, was sehr kostspielig ist. Alternativ ist auch eine Elution über pH Verschiebung möglich, bei der jedoch auch unspezifisch gebundene Proteine eluiert werden. Durch die Kombination von hoher Affinität und hoher Spezifität mit milden Elutionsbedingungen bietet der Twin-Strep-tag® eine perfekte Lösung für effiziente und zuverlässige Pull-Down-Assays.

