Produktformate für die Proteinreinigung
Die Proteinreinigung mittels Affinitätschromatographie basiert auf den Bindesaffinitäten zwischen verschiedenen Molekülen. Bei der Reinigung bindet das mit einem kurzen Peptid markierte Zielprotein an den Liganden, der in der Regel an ein Resin gekoppelt ist, während unerwünschte Proteine ohne Markierung nicht binden und weggewaschen werden können.
Das Resin kann aus Agarose oder magnetischen Beads bestehen. Beide werden in Form einer Suspension geliefert. Alternativ können Agarose-Beads auch in FPLC-, Gravity-flow- oder Zentrifugensäulen gepackt werden. Welches Format sich für Ihre Anwendung am besten eignet, hängt entweder von der gewünschten Ausbeute oder vom ursprünglichen Probenvolumen ab.
Die Wahl des Produktformats auf der Grundlage...
Ausbeute

Volumen der Probe
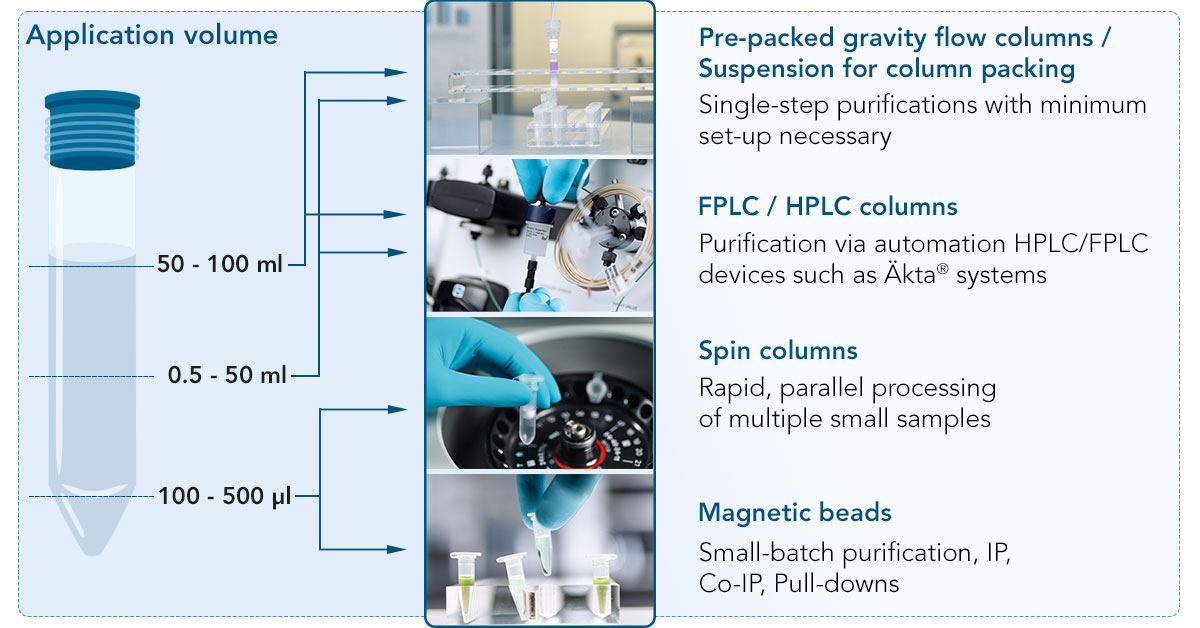
Produktformate im Detail
FPLC/HPLC-Säulen
Große Probenmengen können mit Hilfe von Säulen in automatisierten FPLC/HPLC-Geräten wie Äkta® gereinigt werden. FPLC-Säulen werden mit unterschiedlichen Resinvolumina geliefert und können in Reihe geschaltet werden, um die Bindekapazität zu erhöhen. Sie werden über standardmäßige 10-32-Anschlüsse an das Gerät angeschlossen.
- Breite pH-Kompatibilität
- Ausgezeichnete Druckstabilität
- Hervorragende Proteinreinheit
- Säulen mit 1 ml & 5 ml Säulenbettvolumen verfügbar
- Schneller Auftrag von großen Probenmengen
- Vollständig automatisierte Proteinreinigung
- Zeitersparnis: Kein Warten zwischen den Reinigungsschritten, da das Gerät selbstständig die richtigen Volumina an Puffer und Probe zuführt.
- Aufzeichnung des kompletten Affinitätschromatographie-Protokolls, das Aufschluss über die Reinigungsqualität gibt
- Reproduzierbare Reinigungsergebnisse durch vorher festgelegte, benutzerunabhängige Programmeinstellungen


Gravity-flow-Säulen
Gravity-flow-Säulen sind ideal für Proteinreinigungen mit mittlerer Ausbeute. Die Resinsuspensionen ermöglichen es Ihnen, Ihre eigenen Säulen je nach Bedarf zu packen, aber Sie können auch aus anderen Formaten, wie z. B. vorgepackten Säulen, wählen.
- Optimiert für Säulen-Affinitätschromatographie
- Eine Vielzahl unterschiedlicher Produktgrößen und Matrizen
Prepacked columns
Suspension
Magnetische Beads
Magnetische Beads können für Batch-Reinigungen in Reaktionsgefäßen oder 96-Well-Platten verwendet werden, um Proteine in Pull-downs zu reinigen. Die Beads können einfach mit einem Magneten im Reaktionsgefäß fixiert werden, so dass keine Zentrifugation notwendig ist und Sie sich keine Sorgen machen müssen, dass Zielprotein während der Pipettierschritte verloren geht oder die Reinheit beeinträchtigt wird.
- Keine Zentrifugation
- Abtrennung der Probe über Magnetseparator
- Abfüllungen mit 2 ml oder 10 ml Suspension

Zentrifugensäulen
Wenn Sie mehrere kleine Proben parallel bearbeiten müssen, können Sie Zentrifugensäulen mit dem Resin Ihrer Wahl verwenden. Sie ermöglichen Ihnen die Batch-Reinigung mehrerer Proteine parallel in einem einfachen Setup.
- Kompatibel mit herkömmlichen 1,5 ml oder 2,0 ml Reaktionsgefäßen
- Kaufen Sie ein gebrauchsfertiges Kit oder füllen Sie leere Zentrifugensäulen mit dem Resin Ihrer Wahl

Wiederverwendung des Resins
Strep-Tactin®- und Strep-Tactin®XT-Resins für die Proteinreinigung können >10 Mal* ohne Leistungsverlust regeneriert und wiederverwendet werden. Die Aktivität des Resins kann leicht mit HABA überprüft werden. Die gelbe HABA-Lösung färbt sich nach der Bindung an die Biotin-Bindetaschen von Strep-Tactin® und Strep-Tactin®XT rot (Strep-Tactin®) bzw. orange (Strep-Tactin®XT), was anzeigt, dass das Resin vollständig regeneriert ist. Anschließend kann HABA durch Waschen mit 100 mM NaOH entfernt werden. Sobald die rote Farbe verschwunden ist und NaOH mit Buffer W aus der Säule gewaschen wurde, kann die Säule wiederverwendet werden. Wenn die Biotin-Bindetasche blockiert oder beschädigt ist, tritt keine Farbverschiebung auf und das Resin kann nicht wiederverwendet werden.
*unter idealen Bedingungen können >50 Regenerationszyklen durchgeführt werden

Resin specifications
|
Strep-Tactin® |
Strep-Tactin®XT |
||||
|---|---|---|---|---|---|
| Matrix | Superflow® | Sepharose® | MacroPrep® | 4Flow® | MagStrep Strep-Tactin®XT beads |
| (only available as 20 ml slurry) | |||||
| Binding capacity*/ Dynamic Binding capacity** |
classic: 3 mg/ml resin* | classic: 3 mg/ml resin* | classic: 3 mg/ml resin* | classic: 5 mg/ml resin** | classic: 25.5 µg/µl resin* |
| high capacity: 7.0 mg/ml resin** | high capacity: 14 mg/ml resin** | ||||
| Bead structure | 6% agarose, crosslinked | 4% agarose, crosslinked | polymethacrylate | 4% agarose, highly crosslinked | magnetic core covered with 6% agarose, crosslinked |
| Bead size | 60-160 µm, spherical | 45-165 µm | 50 µm | 50-150 µm, spherical | 30 μm (average), spherical |
| Exclusion limit | 6 x 106 Da | ~3 x 107 Da | 1 x 106 Da | 3 x 107 Da | not specified |
| Recommended flow rate | 0.5-1 ml/min | gravity flow | 0.5-1 ml/min | 0.5-1 ml/min | batch purification |
| pH range for protein binding | 7-8 | 7-8 | 7-8 | 4-10 | 6-10 |
| Max pressure | 9.6 bar | gravity flow | 70 bar | 3.5 bar | batch purification |
| Storage | 4 °C, do not freeze | 4 °C, do not freeze | 4 °C, do not freeze | 4 °C, do not freeze | 4 °C, do not freeze |
| Shipment | RT | RT | RT | RT | RT |
| Eluent | desthiobiotin |
desthiobiotin |
desthiobiotin |
biotin | biotin |
| Regeneration buffer | Buffer R | Buffer R | Buffer R | Buffer XT-R 0.1 M NaOH |
0.1 M NaOH |
| Features and recommendations |
|
|
|
|
|
|
* Max binding capacity for a Strep-tag® protein (30kDa). ** Dynamic binding capacity (DBC) was determined with mCherry-Twin-Strep-tag (30 kDa) under realistic operation conditions and shows the amount of protein which is bound until 10% of the protein is found in the flow through. |
|||||
Spezifikationen der Resins
| Ligand | Strep-Tactin® | Strep-Tactin®XT | ||
|---|---|---|---|---|
| Matrix | 4Flow® high capacity | 4Flow® | 4Flow® high capacity | MagStrep® Strep-Tactin®XT-Beads |
| Bindekapazität | 20 mg/ml Resin* | 11 mg/ml Resin* | 31 mg/ml Resin* | 42,5 mg/ml Beads* |
| Bead-Struktur | 4% Agarose, hoch vernetzt | 4% Agarose, hoch vernetzt | 4% Agarose, hoch vernetzt | Magnetkern bedeckt mit 6% Agarose, vernetzt |
| Größe der Beads | 50-150 µm, kugelförmig | 50-150 µm, kugelförmig | 50-150 µm, kugelförmig | 30 μm (Durchschnitt), kugelförmig |
| Ausschluss-grenze | 3 x107 Da | 3 x107 Da | 3 x107 Da | nicht angegeben |
| Empfohlenes Verfahren | Gravity-flow, FPLC | Gravity-flow, FPLC, Zentrifugation | Gravity-flow, FPLC, Zentrifugation |
Batch-Reinigung |
| pH-Bereich für die Proteinbindung | 7-8 | 4-10 | 4-10 | 6-10 |
| Maximaler Druck | 3,5 bar | 3,5 bar | 3,5 bar | |
| Lagerung | 2-8 °C, nicht einfrieren | 2-8 °C, nicht einfrieren | 2-8 °C, nicht einfrieren | 2-8 °C, nicht einfrieren |
| Versand | RT | RT | RT | RT |
| Elutionsmittel | Desthiobiotin | Biotin | Biotin | Biotin |
| Regenerationspuffer | 100 mM NaOH | Buffer XT-R 100 mM NaOH |
Buffer XT-R 100 mM NaOH |
100 mM NaOH |
| Aktivitätstest | Buffer R (HABA) | Buffer R (HABA) | Buffer R (HABA) | |
| Eigenschaften und Empfehlungen |
|
|
|
|
|
*bestimmt mit einem 50-kDa-Twin-Strep-tag-Fusionsprotein |
||||
Anwendungsbeispiel
Der Zellkulturüberstand von MEXi-293E-Zellen (24 ml) wurde mit 240 µg eines großen Proteins (130 kDa) versetzt, das C-terminal mit dem Twin-Strep-tag® markiert ist. Die Proteinreinigung erfolgte mit Strep-Tactin®XT 4Flow® (Gravity-flow-Säule, 0,2 ml). Nach dem Probenauftrag wurde die Säule mit 1x Buffer W gewaschen. Das Twin-Strep-tag-Protein wurde in drei Elutionsschritten mit 0,7, 1,5 und 0,8 CV 1x Buffer BXT eluiert. Die Reinigungsergebnisse wurden mittels SDS-PAGE (A) und Western Blot (B) analysiert. Beide zeigen einen Molekulargewichtsmarker (M*, Precision Plus Protein™ Unstained Protein Standards, Strep-tagged recombinant (BioRad), M** PageRuler™ Plus Prestained Protein Ladder (Thermo Fisher Scientific)), den ,mit Zielprotein versetzten Zellkulturüberstand (S), den Durchfluss (FT), die erste und fünfte Waschfraktion (W1 bzw. W5) und die Elutionsfraktionen (E1-E3). Für den Nachweis im Western Blot wurde Strep-Tactin® HRP eingesetzt (1:4000).