Protein-Affinitätschromatographie
Um ein Protein mit Hilfe seiner Affinität zu einem anderen Molekül zu reinigen, wird der Interaktionspartner (Ligand), z. B. ein Protein, ein kleines Molekül oder ein Metall, an der stationären Phase der Chromatographiematrix immobilisiert. Die stationäre Phase besteht meist aus Agarose oder synthetischen Polymeren und ist in Form von Beads in eine Säule gepackt. Die Beads sind von einer Flüssigkeit, der so genannten mobilen Phase, umgeben. Wenn die zielproteinhaltige Probe aufgetragen wird, gelangt sie in die mobile Phase und läuft durch die Beads der stationären Phase. Währenddessen kann das Zielprotein an den Liganden binden. Andere Moleküle verbleiben in der mobilen Phase und können durch Waschen entfernt werden. Durch eine Änderungen der Pufferbedingungen kann die Elution des Zielproteins eingeleitet werden. Solche Änderungen können beispielsweise die Verschiebung des pH-Werts sein oder die Zugabe eines Kompetitors, der das Zielprotein vom Liganden verdrängt. Der Ligand wird durch die Änderung der Pufferbedingungen nicht abgelöst und bleibt an der stationären Phase immobilisiert.
Eine solche direkte Affinitätsreinigungsstrategie wird am häufigsten für Antikörper verwendet, die auf Antigen-Antikörper-Wechselwirkungen basieren. Ein Beispiel ist Protein A (Ligand), das zur Reinigung von Immunglobulin-G-Antikörpern (Zielprotein) verwendet werden kann. Aber wie kann ein Protein gereinigt werden, wenn der Interaktionspartner noch nicht bekannt ist? In diesem Fall kann die Affinität einer bekannten Interaktion für die indirekte Immobilisierung des Zielproteins genutzt werden. Das Zielprotein wird mit einem Peptid des einen Interaktionspartners markiert, das an den anderen auf der stationären Phase immobilisierten Interaktionspartner (Ligand) binden kann. Das kurze Peptid des bekannten Interaktionspartners wird als Affinitäts-Tag bezeichnet und kann z. B. der His-tag, GST-tag, Strep-tag®II oder Twin-Strep-tag® sein. Sie können an Liganden wie Metallionen, Glutathion, Strep-Tactin® bzw. Strep-Tactin®XT binden.
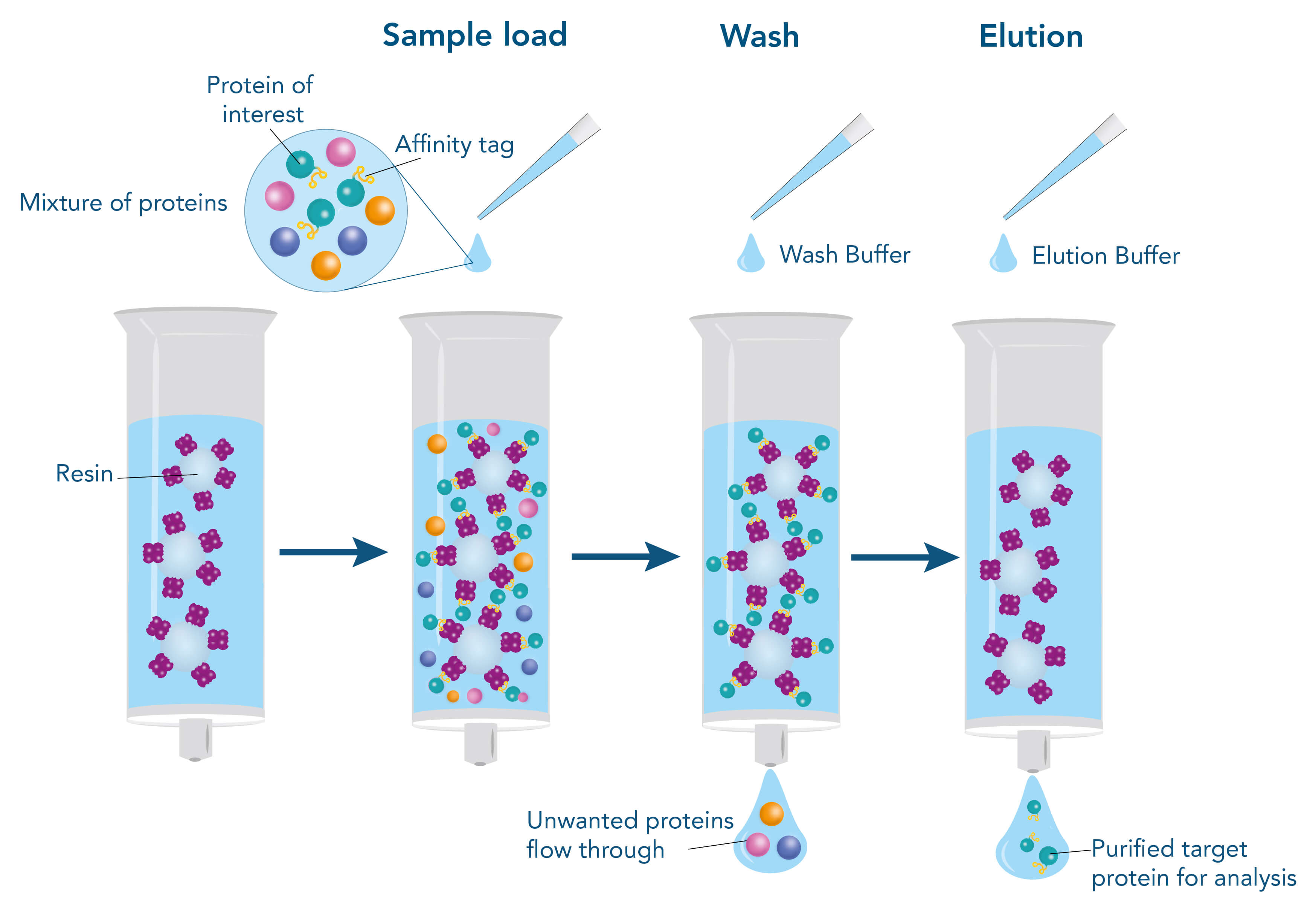
Prinzip der affinitätsbasierten Proteinreinigung
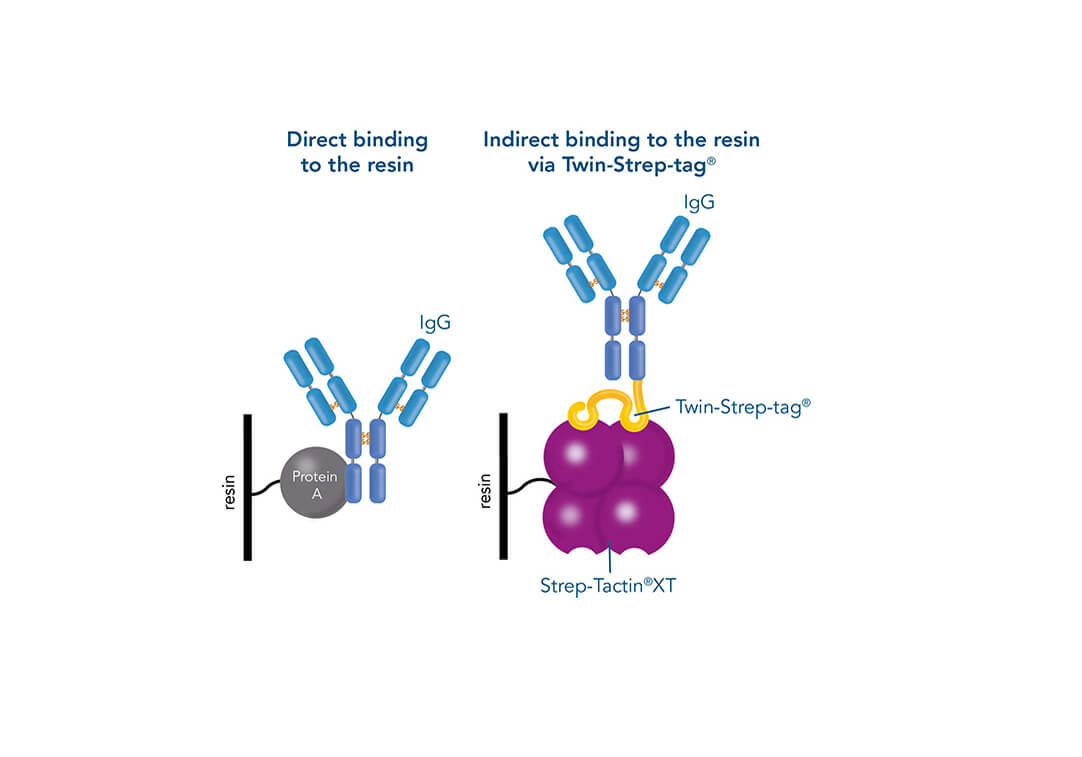
Vergleich von direkten und indirekten Affinitätsreinigungsstrategien
Aufgrund der hochspezifischen Selektion und der daraus resultierenden Reinheit der Zielproteine haben sich affinitätsbasierte Systeme zu einer der wichtigsten Reinigungsmethoden entwickelt. Einige der weit verbreiteten Affinitäts-Tags, wie z. B. der His-tag, weisen jedoch mehrere Nachteile und Einschränkungen auf, da sie die Protein-Konformation verändern können oder scharfe Elutions- und Waschbedingungen erfordern, die die Ausbeute an funktionalen Zielprotein beeinträchtigen. Darüber hinaus sind viele Tags mit unterschiedlichen Pufferbedingungen nicht kompatibel und müssen entfernt werden, um die nachfolgenden Analysen nicht zu beeinträchtigen.
Die weit verbreitete Strep-tag®-Technologie, die aus den beiden Streptavidin-Varianten Strep-Tactin® und Strep-Tactin®XT sowie den beiden Affinitäts-Tags Strep-tag®II und Twin-Strep-tag® besteht, ist in der Verwendung von Puffern nicht eingeschränkt und führt dank ihrer hohen Spezifität zur Gewinnung hochreiner Proteine.
Daher bietet IBA verschiedene Resins an, die entweder mit Strep-Tactin® oder Strep-Tactin®XT gekoppelt sind und für die Reinigung von sowohl Strep-tagII- als auch Twin-Strep-tag-Fusionsproteinen gleichermaßen geeignet sind. Der Reinigungszyklus variiert zwischen den beiden Streptavidin-Varianten, aber alle Resins dienen dem gleichen Ziel: einfache, schnelle und variable Proteinreinigung für hochreine Proteine.
In den folgenden Applications Notes wird das Strep-Tactin- und Strep-TactinXT-Reinigungssystems am Beispiel der Reinigung von Latex Clearing Protein und weiteren Proteine(1, 2) verglichen.
Die besonderen Unterschiede zwischen dem His-tag System und der Strep-tag® Technologie, werden in einem umfassenden Vergleich dargestellt. Der Vergleich fasst zusammen, welche Unterschiede es gibt und empfiehlt eines der Systeme in Abhängigkeit von den Eigenschaften des Zielproteins, des Expressionswirts und der Reinigungsbedingungen.
Die Unterschiede zwischen den Systemen bei der Proteinreinigung aus Expi-Überständen werden in dieser Application Note aufgezeigt.
Die einzigartige Strep-tag®-Technologie von IBA ist ein häufig verwendetes Werkzeug für die Affinitätsreinigung rekombinanter Proteine und basiert auf einer der stärksten nicht-kovalenten Interaktion in der Natur, nämlich der Interatkion von Biotin mit Streptavidin. Das System umfasst zwei Affinitäts-Tags: Strep-tag®II und Twin-Strep-tag® (die Tandemversion des Strep-tag®II). Diese Peptidsequenzen weisen eine intrinsische Affinität zu zwei speziell entwickelten Streptavidin-Varianten auf - Strep-Tactin® und Strep-Tactin®XT.
Die Strep-tag-Technologie steht für höchste Proteinreinheiten unter physiologischen Bedingungen und kann neben der Reinigung in einer Vielzahl unterschiedlicher Anwendungen eingesetzt werden, zum Beispiel im Bereich der der Immobilisierung von Proteinen für die Entwicklung von Assays oder für Proteininteraktionsstudien.

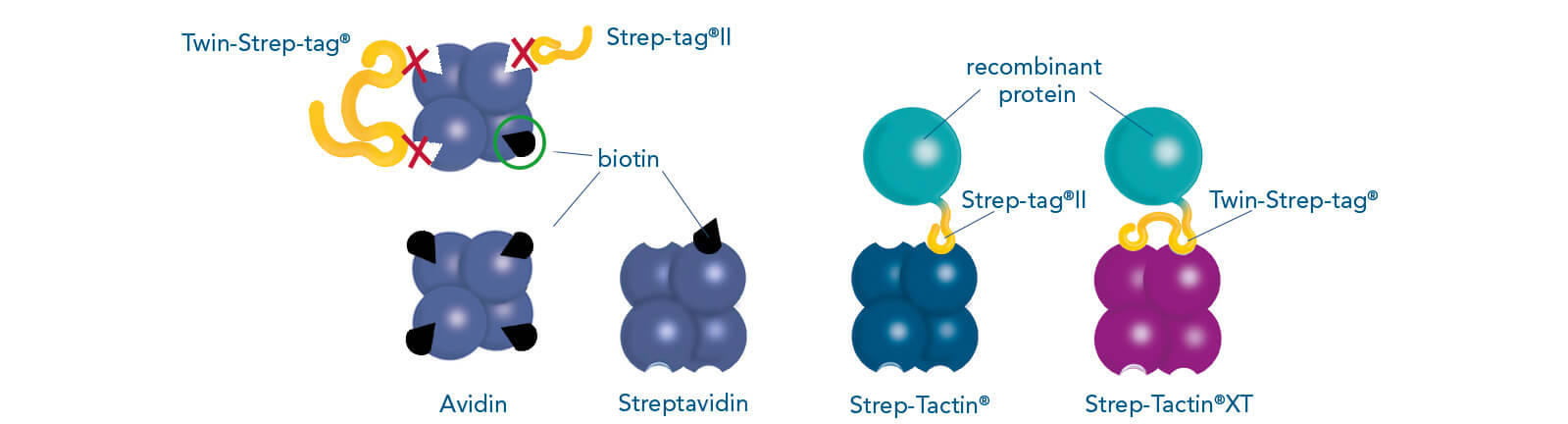
Bindungsmuster von Strep-tag®II, Twin-Strep-tag® und Biotin

