Western Blot
Die Western-Blot-Technik ist eine Methode zur Identifizierung spezifischer Proteine aus einem komplexen Gemisch. Nach der Extraktion des Proteingemischs, z. B. durch Zelllyse, werden die Proteine zunächst durch Gelelektrophorese nach ihrem Molekulargewicht getrennt. Für die Proteintrennung nach Größe wird in der Regel ein Polyacrylamidgel verwendet. Anschließend werden die Proteine vom Gel auf einen festen Träger, in der Regel eine Nitrocellulose- oder Polyvinylidendifluorid (PVDF)-Membran, übertragen oder geblottet. Aufgrund seiner Effizienz und Schnelligkeit ist der elektrophoretische Transfer das gängigste Blotting-Verfahren. Das Gel und die Membran werden zwischen zwei Elektroden "platziert", und die Proteine werden durch ihre elektrophoretische Mobilität, die durch Faktoren wie Ladung und Größe beeinflusst wird, übertragen.
Da die Membranen eine hohe Affinität für Proteine haben, müssen die verbleibenden Bindungsstellen auf der Oberfläche nach dem Transfer blockiert werden, um eine unspezifische Bindung der Nachweisantikörper zu verhindern. Während des gesamten Prozesses wird eine Vielzahl verschiedener Puffer und Reagenzien verwendet. Um das Signal-Rausch-Verhältnis zu minimieren, ist ein ausreichender Waschvorgang als Zwischenschritt erforderlich.
Für den Nachweis des Antigens kann zwischen dem direkten und dem indirekten Nachweis gewählt werden. Für den direkten Nachweis von Strep-getaggten Proteinen ist nur ein einziger markierter und zielspezifischer Antikörper, wie unser StrepMAB-Classic, konjugiert mit HRP, erforderlich. Obwohl die Verwendung von Antikörpern für die Detektion durchaus üblich ist, stellen unsere Strep-Tactin®-Produkte, die mit HRP oder AP konjugiert sind, eine ebenso vorteilhafte Alternative dar. Diese Produkte basieren auf unserer Strep-tag®-Technologie.
Die Kombination aus einem primären Antikörper, der das Zielprotein nachweist, und einem markierten sekundären Antikörper ist ebenfalls weit verbreitet, da der zweite Antikörper zu einer Signalverstärkung führt und verschiedene Optionen für mehrere Nachweisverfahren bietet. Die Wahl des primären und sekundären Antikörpers hängt von verschiedenen Parametern ab, wie der Herkunft des Zielproteins, der Spezies des primären Antikörpers oder der gewünschten Nachweismethode. Bei der Arbeit mit Strep-markierten Proteinen ist unser muriner StrepMAB-Classic-Antikörper eine gute Wahl als Primärantikörper.
Die heute am häufigsten verwendeten Marker sind Fluorophore oder Enzyme. Wie im Fall von ELISA sind Meerrettichperoxidase (HRP) oder alkalische Phosphatase (AP) die am häufigsten verwendeten Enzyme. Obwohl enzymatische Markierungen zusätzliche Schritte erfordern und in der Regel optimiert werden müssen, werden sie aufgrund der hohen Empfindlichkeit und der Flexibilität bei der Erkennung durch die Wahl zwischen chromogenen, fluorogenen und chemilumineszenten Substraten am häufigsten verwendet. Bei der Verwendung von Fluorophoren als Marker sind weniger Schritte erforderlich, da keine Substratentwicklung notwendig ist. Hierfür bieten wir verschiedene Fluoreszenzmarker an, die an Strep-Tactin®XT, StrepMAB-Immo oder StrepMAB-Classic konjugiert sind. Die Wahl des experimentellen Verfahrens ist in der Regel von der Laborausstattung abhängig, z.B. werden spezielle Geräte für den Nachweis eines Fluoreszenzsignals benötigt.
Insgesamt bietet das relativ einfache Protokoll für Western Blots eine breite Palette von Einsatzmöglichkeiten, wie z. B. den Nachweis posttranslationaler Modifikationen oder die Überprüfung der Klonierung von Proteinen, und macht es zu einer beliebten Anwendung.
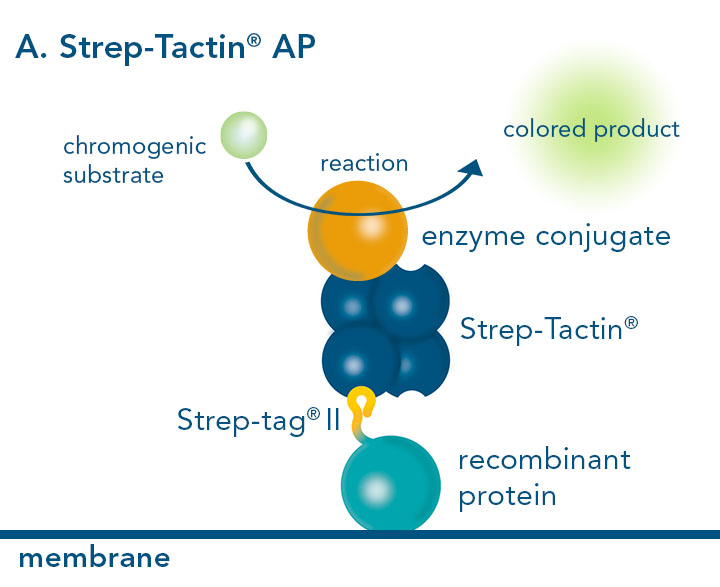
Western Blot mit Strep-Tactin® konjugiertem AP
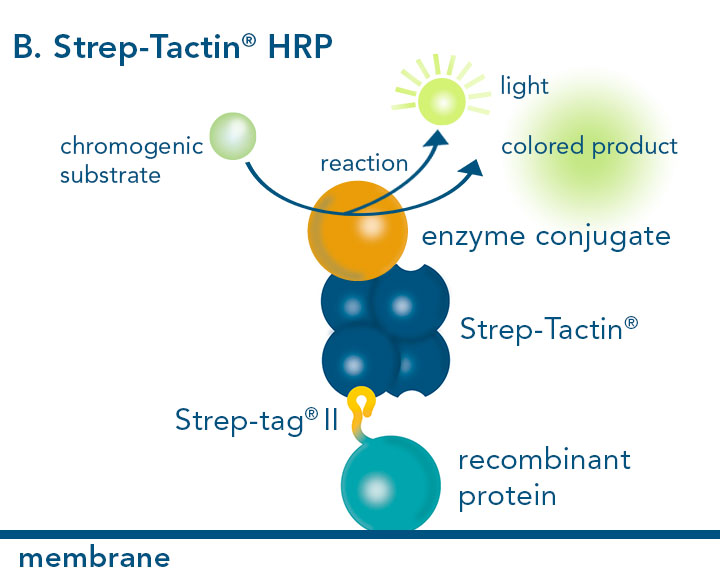
Western Blot mit Strep-Tactin®-konjugiertem HRP
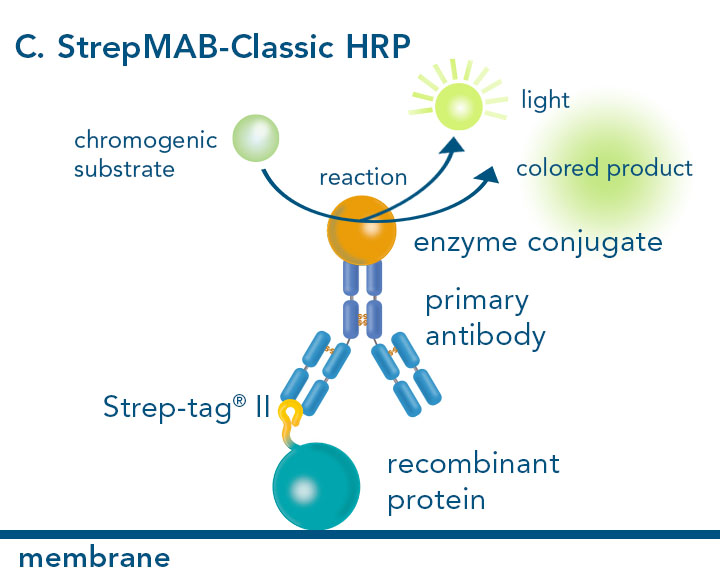
Western Blot mit StrepMAB-Classic konjugiertes HRP
Anwendungsbeispiele
Proteinnachweis mit Strep-Tactin® Konjugaten
Strep-Tactin® Konjugate können für verschiedene Assay-Anwendungen eingesetzt werden. Als Beispiel wird die Anwendung von Strep-Tactin®HRP und Strep-Tactin®AP für Western Blot und Dot Blot gezeigt.
Strep-Tactin®HRP
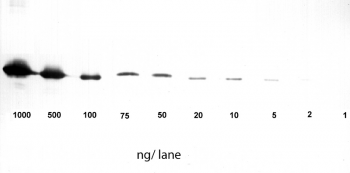
Anwendung: Western Blot
1-1000 ng/l GFP C-terminal markiert mit Strep-tag®II (28 kDa) wurden durch SDS-PAGE getrennt und auf eine Membran geblottet. Die Detektion erfolgte mit Strep-Tactin® HRP.
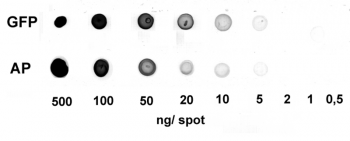
Anwendung: Dot Blot
0,5-500 ng/Spot GFP-Strep-tagII (28 kDa) oder alkalische Phosphatase C-terminal markiert mit Strep-tag®II (Monomer 48,5 kDa) wurden auf eine Membran getupft. Die Detektion erfolgte mit Strep-Tactin® HRP.
Strep-Tactin®AP
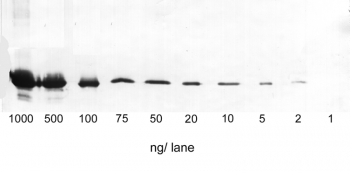
Anwendung: Western Blot
1-1000 ng/l GFP C-terminal markiert mit Strep-tag®II (28 kDa) wurden durch SDS-PAGE getrennt und auf eine Membran geblottet. Die Detektion erfolgte mit Strep-Tactin® AP.
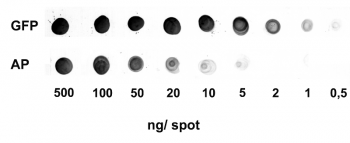
Anwendung: Dot Blot
0,5-500 ng/Spot GFP-Strep-tagII (28 kDa) oder alkalische Phosphatase C-terminal markiert mit Strep-tag®II (Monomer 48,5 kDa) wurden auf eine Membran getupft. Die Detektion erfolgte mit Strep-Tactin® AP.

