Oberflächenplasmonenresonanz (SPR)
Die Oberflächenplasmonenresonanz (SPR) ist eine optische Biosensoranwendung für direkte, Echtzeit- und markierungsfreie Messungen. Sie ermöglicht die Bestimmung von Proteinkonzentrationen sowie die Analyse der Affinität und Kinetik eines bestimmten Proteins zu anderen Proteinen, DNA, RNA oder Zellen. Dies macht SPR zu einem innovativen Instrument für biomolekulare Interaktionsstudien. SPR spielt eine wesentliche Rolle bei der Entdeckung und Entwicklung von biotherapeutischen Arzneimitteln. Das Prinzip der SPR ist eine optische Messung, die die Bindung eines Biomoleküls in Lösung (Analyt) an ein Biomolekül nachweist, das auf einer goldbeschichteten Oberfläche eines Biosensorchips immobilisiert ist (Ligand). Dabei werden Änderungen des Brechungsindexes bestimmt, die proportional zur Konzentration des gebundenen Analyten an der Oberfläche des Biosensorchips sind.
Ein entscheidender Schritt bei der SPR-Analyse ist die Immobilisierung des Liganden an der Oberfläche des Biosensorchips. Die Immobilisierung des Liganden kann durch direkte kovalente Kopplung an die Oberfläche des Chips oder durch Einfangen mit Hilfe eines vorbeschichteten Fängermoleküls erfolgen. Die direkte kovalente Immobilisierung des Liganden kann jedoch seine biologische Aktivität verändern oder zu einer ungerichteten Immobilisierung mit reduzierter Zugänglichkeit der Bindungsstellen führen. Die vorübergehende Immobilisierung markierter Liganden über Affinitätsfängermoleküle überwindet diese Nachteile.
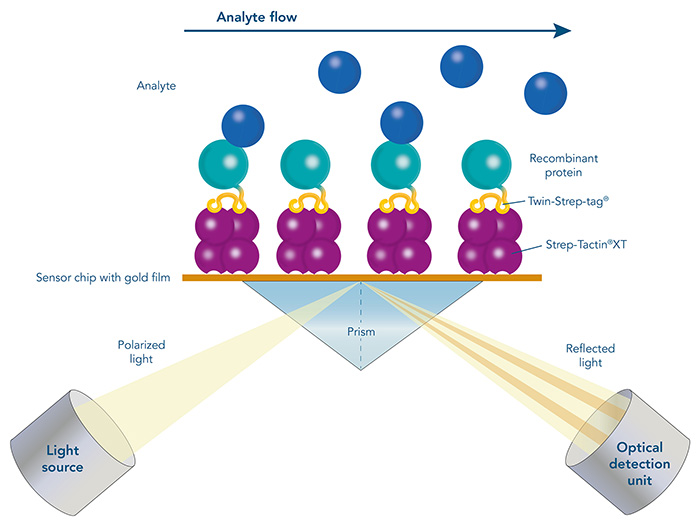
Oberflächenplasmonenresonanz (SPR) mit Strep-Tactin®XT beschichteten Sensorchips
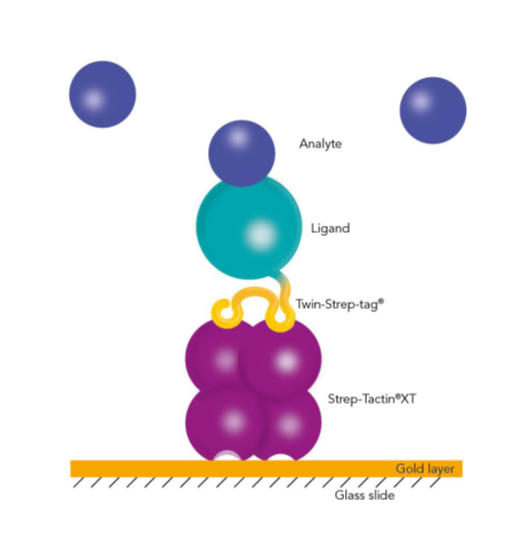
Erfassung von Twin-Strep-tag®-Proteinen mit BiacoreTM
Die für solche Anwendungen verwendeten Tags müssen effizient und mit einer Affinität, die höher ist als die zwischen Analyt und Ligand an das Fängermolekül binden. His-markierte Liganden, die auf einer NTA-Oberfläche mit einer KD im nanomolaren Bereich immobilisiert sind, können für die Messung schwächerer Wechselwirkungen verwendet werden, versagen aber bei der Messung von hochaffinen Wechselwirkungen mit langsamen Dissoziationsraten. Im Gegensatz dazu bildet Strep-Tactin®XT einen außergewöhnlich starken Komplex mit dem Twin-Strep-tag®. Eine Affinität im niedrigen pikomolaren Bereich ermöglicht die Messung langer Dissoziationszeiten und langsamer Disassoziationsraten.
Die Kombination dieser beiden Teile der Strep-tag®-Technologie ermöglicht somit eine gezielte, hochaffine Immobilisierung, welche die Aktivität des Liganden nicht beeinflusst und keine Modifikationen erfordert. Aufgrund der hochaffinen Wechselwirkung und ihrer hohen Spezifität wird eine unspezifische Bindung von Wirtszellproteinen vermieden, und Liganden können effizient und direkt aus Kulturmedien gewonnen werden. Außerdem ist Strep-Tactin®XT mit vielen Substanzen kompatibel und die Biosensoren können leicht regeneriert werden. Das Twin-Strep-tag® Capture Kit enthält alle notwendigen Produkte für die Herstellung von Strep-Tactin®XT-beschichteten Biosensorchips und die darauffolgenden Messungen.
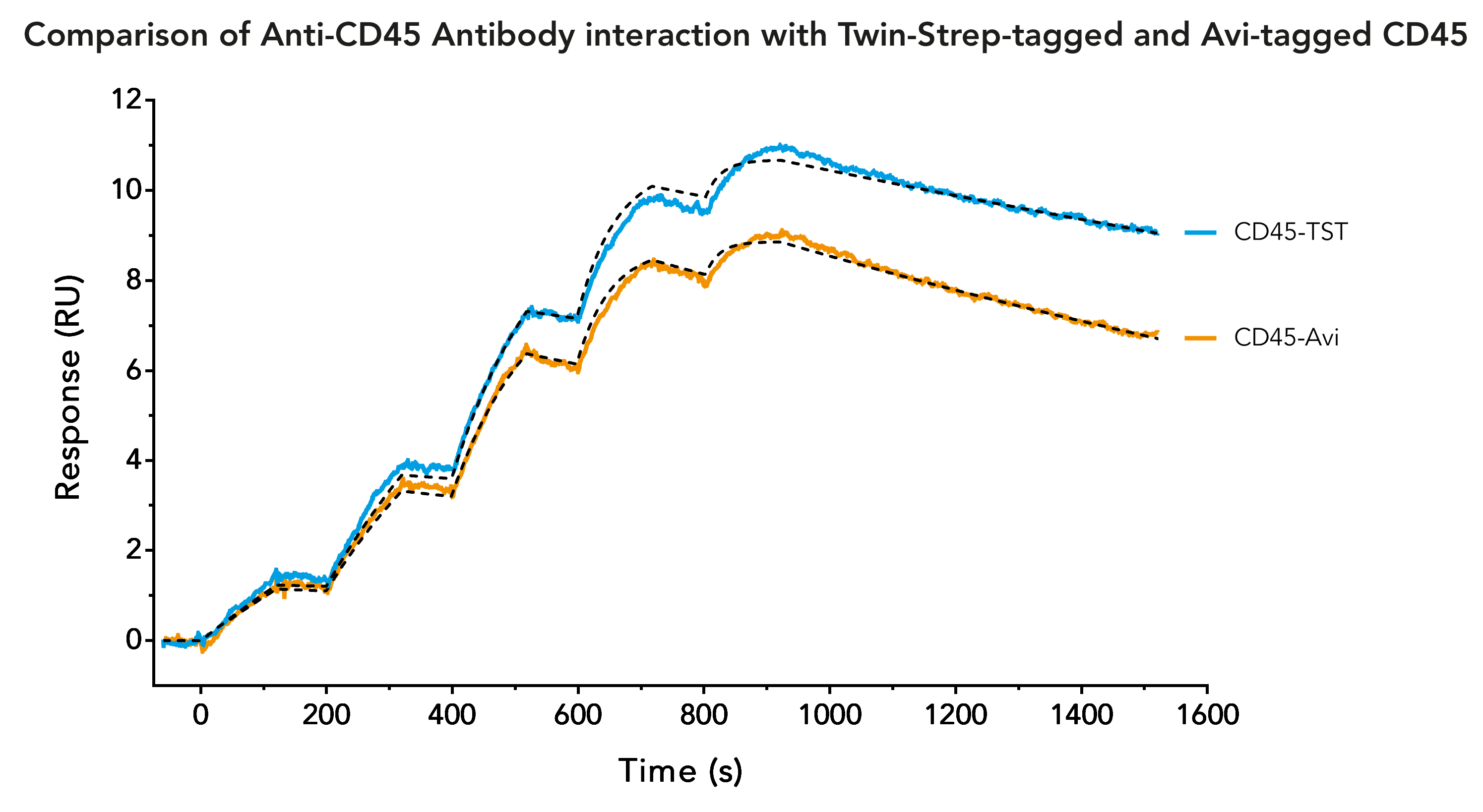
Twin-Strep-tag® - eine zuverlässige und zeitsparende Alternative zu Avi-tag in der Oberflächenplasmonenresonanz (SPR)-Analyse
Die Oberflächenplasmonenresonanz (SPR) ist eine leistungsstarke Methode zur Untersuchung biomolekularer Wechselwirkungen. Aufgrund ihrer hohen Genauigkeit und der Möglichkeit, Proben in hohem Durchsatz zu messen, spielt sie eine wichtige Rolle in der Forschung und Entwicklung von Arzneimitteln.
Ein gängiger Protein-Tag, der häufig zur Immobilisierung von Liganden auf SPR-Biosensorchips verwendet wird, ist der Avi-Tag. Er zeichnet sich durch seine hohe Bindungsaffinität und Spezifität für Streptavidin aus. Die Kombination von Avi-Tag und Streptavidin ermöglicht Langzeitmessungen von Wechselwirkungen mit hoher Affinität und langsamen Dissoziationsraten.
Erfolgreiche SPR-Messungen erfordern eine ausreichende Menge an hochreinem Liganden. Obwohl die Bindung an Streptavidin sehr stark ist, ist der Avi-Tag nicht ideal für die erste Reinigung eines ausgewählten Liganden. Die verfügbaren Resins für die Reinigung von Avi-Tag-Proteinen sind teuer und liefern nur eine geringe Ausbeute an Protein. Die Lösung für dieses Problem ist die Verwendung eines zweiten, besser geeigneten Tags für die anfängliche Ligandenaufreinigung. Aufgrund seiner hohen Reinheit bei der Proteinaufreinigung sowie der höheren Ausbeute und der geringeren Kosten wird der Twin-Strep-tag® häufig als zweiter Tag verwendet. Eine häufige Frage ist daher, ob der Twin-Strep-tag® und der Avi-tag® für dasselbe Protein verwendet werden können.
Die Antwort ist: Twin-Strep-tag® und Avi-tag sollten nicht für dasselbe Protein verwendet werden! Die Biotinylierung des Avi-tags kann die Bindung von Twin-Strep-tag® beeinträchtigen, da der Bindungspartner von Twin-Strep-tag® eine Streptavidin-Mutante, gennant Strep-Tactin®XT ist. Strep-Tactin®XT hat eine Restaffinität zu Biotin und biotinylierten Proteinen, was die SPR-Messungen beeinträchtigen kann. Umgekehrt hat Twin-Strep-tag® immer noch eine schwache Affinität zu Streptavidin, was die SPR-Messungen ebenfalls beeinflussen kann.
Die Lösung für die Inkompatibilität von Avi-tag und Twin-Strep-tag® ist einfach. Der Avi-tag wird für SPR-Messungen nicht benötigt, da Twin-Strep-tag® ebenso effektiv zur Proteinimmobilisierung eingesetzt werden kann. Neben der Eignung für das gesamte Verfahren von der Aufreinigung bis zur Immobilisierung hat die Verwendung von Twin-Strep-tag® noch weitere Vorteile:
- Strep-Tactin®XT hat eine pM-Affinität für Twin-Strep-tag®, daher ist die Kombination ideal für die Analyse von Wechselwirkungen mit hoher Affinität und langsamen Dissoziationsraten geeignet.
- Die Reversibilität der Bindung ermöglicht die Wiederverwendung der Sensorchips
- Effiziente und einfache Ein-Schritt-Reinigungsmethode - keine mühsame zusätzliche Biotinylierung
Daher ist die Verwendung des Twin-Strep-tag®/Strep-Tactin®XT-Systems kosteneffizient und zeitsparend und die bevorzugte Wahl bei der Planung kinetischer Messungen wie SPR.
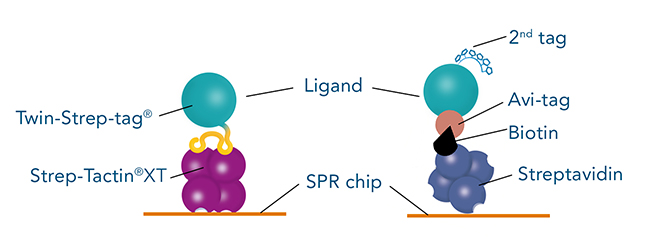
Twin-Strep-tag® - direkte und zeitsparende Proteinaufreinigung mit hohen Ausbeuten
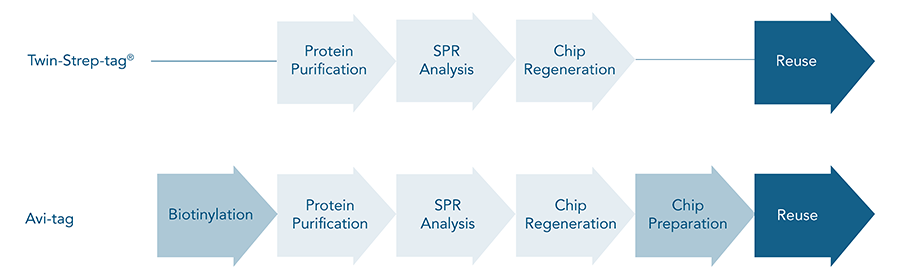
Die einfache Anwendung, die hohe Reinheit und Ausbeute sind alles Merkmale die zeigen, dass der Twin-Strep-tag® dem Avi-tag für die Proteinreinigung überlegen ist. Darüber hinaus bietet die hohe Affinität zu Strep-Tactin®XT die Möglichkeit einer effizienten Ligandenimmobilisierung, die für SPR- oder andere Analysen der Bindungskinetik erforderlich ist, wodurch der Avi-tag überflüssig wird.
Twin-Strep-tag® bietet pM-Affinität zur Untersuchung hochaffiner Wechselwirkungen
Für die SPR-Analyse muss ein Ligand auf einem Biosensorchip immobilisiert werden. Zu diesem Zweck wird häufig die Avi-tag/Streptavidin-Wechselwirkung verwendet, da sich die Bindung durch eine außergewöhnlich hohe Affinität auszeichnet. Eine weitere Wechselwirkung, die die Möglichkeit einer effizienten Immobilisierung bietet, ist die Bindung von Twin-Strep-tag® an Strep-Tactin®XT. Mit einer Affinität im niedrigen pikomolaren Bereich können bei SPR-Analysen ähnliche Ergebnisse erzielt werden wie mit der Kombination Avi-tag/Streptavidin. Die Halbwertszeit des Twin-Strep-tag®/Strep-Tactin®XT-Komplexes beträgt 13 Stunden, was Messungen von hochaffinen Wechselwirkungen über einen langen Zeitraum ermöglicht.
Die Flexibilität der Twin-Strep-tag®/Strep-Tactin®XT-Kombination bei der Aufreinigung und Analyse macht sie zu einer großartigen Alternative zur Avi-tag/Streptavidin-Interaktion. Durch die Wahl des Twin-Strep-tags® wird der gesamte Arbeitsablauf zu einem zeitsparenden und kostengünstigen Prozess.
Kostenreduzierung mit regenerierbaren Strep-Tactin®XT-Biosensorchips
Eine Interaktionsanalyse umfasst immer mehrere Messungen. Daher ist die Möglichkeit der Wiederverwendung eines Biosensorchips von großem Vorteil, da sie die mit einem Experiment verbundenen Kosten reduziert.
Die Möglichkeit der Regeneration von Biosensorchips besteht sowohl für das Avi-tag/Streptavidin als auch für das Twin-Strep-tag®/Strep-Tactin®XT-System. Wichtige Unterschiede zwischen diesen beiden Systemen sind jedoch die Wirksamkeit, die Einfachheit des Verfahrens und die Kosten für die Regeneration eines Chips.
Aufgrund seiner hohen Affinität ist die Avi-Tag/Streptavidin-Wechselwirkung zu stark, um sich aufzulösen. Daher besteht die einzige effiziente Möglichkeit zur Wiederverwendung eines Chips darin, den gesamten Ligand/Streptavidin-Komplex zu entfernen.
Eine neue Generation von Streptavidin-Biosensorchips wird mit einem etablierten Regenerationsprotokoll geliefert. Bei diesem Protokoll wird das Streptavidin während der Regeneration freigesetzt und muss vor der nächsten Ligandenapplikation erneut aufgetragen werden. Ein Nachteil dieser Streptavidin-Biosensorchips ist, dass sie doppelt so teuer sind wie die Strep-Tactin®XT-Biosensorchips. Eine billigere, aber aufwändige und oft ineffiziente Möglichkeit ist die Verwendung herkömmlicher Streptavidin-Biosensorchips. Für die Regeneration dieser Chips müssen für jeden unterschiedlichen Liganden optimale Regenerationsbedingungen ermittelt werden. Schließlich kann es sein, dass für jede Messung ein neuer Chip benötigt wird, da das Verfahren auch die Aktivität des Liganden beeinflussen kann.
Im Gegensatz zu Avi-tag/Streptavidin, wo es sich um eine nahezu irreversible Bindung handelt, kann die Twin-Strep-tag®/Strep-Tactin®-Interaktion leicht aufgelöst werden. Obwohl die Bindungsaffinität sehr hoch ist, bewirkt die Zugabe von Guanidinhydrochlorid (GuHCl) die vollständige Freisetzung des Strep-getaggten Liganden von Strep-Tactin®XT. Strep-Tactin®XT verbleibt auf dem Biosensorchip und wird durch dieses Verfahren nicht beeinträchtigt. Das Protokoll ist schnell und einfach und ermöglicht es, die Chips mehr als 30 Mal zu regenerieren, ohne die Funktionalität zu beeinträchtigen.
Stabile Leistung von Strep-Tactin®XT-Biosensorchips nach mehreren Regenerationszyklen
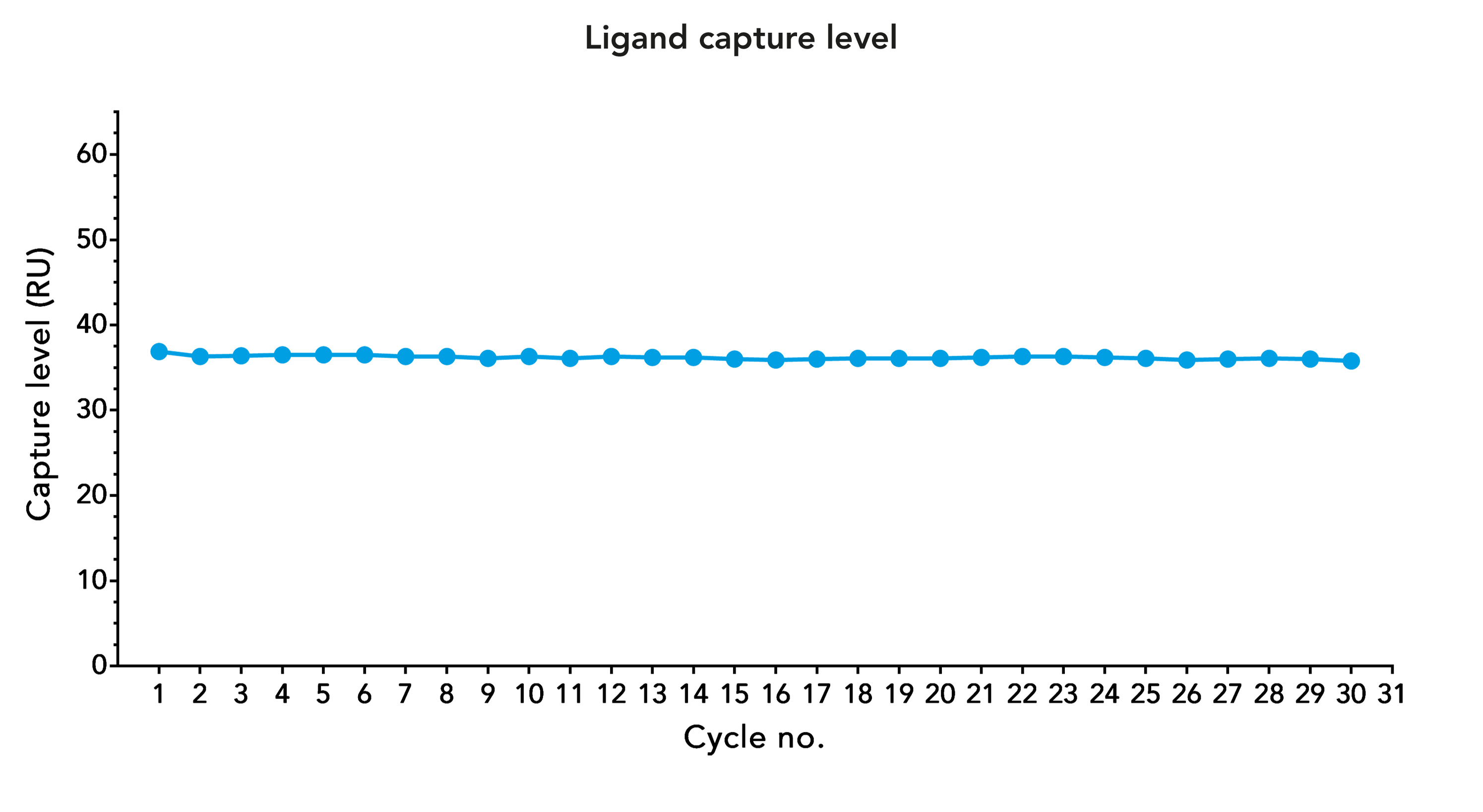
Abb. 4: Ligand Capture Level von CD45-Twin-Strep-tag® auf einem Strep-Tactin®XT beschichteten CM5-Chip nach mehreren Regenerationszyklen. Die Regeneration wurde mit drei aufeinanderfolgenden 1-minütigen Injektionen von 3 M GuHCl durchgeführt.
Eine überlegene Alternative zu His-tag/NTA - Stabile, reversible und hochspezifische Immobilisierung auf SPR-Sensorchips mit Strep-Tactin®XT
Xantec bioanalytics hat sich mit IBA Lifesciences zusammengetan, um das Strep-Tactin®XT/Twin-Strep-tag®-System als neues Derivat auf SPR-Sensorchips einzuführen.
Das Strep-Tactin®XT/Twin-Strep-tag®-System bietet mehrere entscheidende Vorteile gegenüber dem herkömmlichen His-tag/NTA-System für SPR-Sensorchips, darunter eine hohe Affinität und Bindungsstabilität im niedrigen picomolaren Bereich, was es für die Proteinimmobilisierung außerordentlich zuverlässig macht. Der Regenerationsprozess ist einfach und unterstützt über 100 Zyklen mit minimalem Kapazitätsverlust, was die Nutzbarkeit und Effizienz des Systems erhöht.
Darüber hinaus weist das Strep-Tactin®XT/Twin-Strep-tag®-System im Vergleich zum His-tag/NTA-System deutlich weniger unspezifische Wechselwirkungen auf, was insbesondere für Anwendungen mit größeren Analyten von Vorteil ist. Die spezifische Immobilisierung erfolgt unter physiologischen Bedingungen, wodurch die hohe biologische Aktivität erhalten bleibt und die Reproduzierbarkeit gewährleistet ist.
Die Strep-Tactin®XT/Twin-Strep-tag®-Sensorchip-Varianten sind für verschiedene Anwendungen wie Protein-Protein-Interaktionen, Fragment-Screening und Konzentrationsanalysen optimiert. Insgesamt bietet das System eine stabilere, spezifischere und effizientere Methode für die SPR-Sensorchip-Immobilisierung, die die Einschränkungen des His-tag/NTA-Systems überwindet und die Zuverlässigkeit SPR-basierter Analysen erhöht.
Anwendungsbeispiele
Strep-Tactin®XT
Strep-Tactin®XT bindet mit hoher Affinität Twin-Strep-tag®-Proteine und eignet sich daher hervorragend für die SPR-Analyse. Die Beispiele zeigen die Kopplung von Strep-Tactin®XT auf verschiedenen SPR-Chips und mögliche Regenerationsbedingungen für die Wiederverwendung von Strep-Tactin®XT-beschichteten Chips.
Kopplung auf CM5

Für eine optimale Kopplung von Strep-Tactin®XT empfehlen wir die folgenden Bedingungen zu verwenden:
- 20-50 µg/ml Strep-Tactin®XT
- max. 20 mM Acetat, pH 4,5
Mit diesen Bedingungen für die Strep-Tactin®XT-Kopplung lassen sich effiziente und reproduzierbare Kopplungsergebnisse erzielen.
Kupplung am CM4

Das Membranprotein CB2 wurde mit Twin-Strep-tag® fusioniert und anschließend auf einem mit Strep-Tactin®XT beschichteten CM4-Sensorchip immobilisiert.
Verwendete Bedingungen:
- 50 mM Tris pH 7,5, 100 mM NaCl
- 10 % Glycerin, 0,1 % DDM, 0,5 % CHAPS, 0,1 % CHS
Daten wurden veröffentlicht in A. Yeliseev et al., Protein Expression and Purification 131 (2017) 109-118
Regeneration

Drei verschiedene Regenerationsbedingungen wurden auf Strep-Tactin®XT CM5 Sensorchips getestet:
- 10 mM NaOH / 500 mM NaCl
- 3 M MgCl2
- 3 M GuHCl
für drei verschiedene Twin-Strep-tag®-Fusionsproteine:
- mCherry-Twin-Strep-tag
- GAPDH-Twin-Strep-Tag
- mAb-Twin-Strep-tag
Wir empfehlen die Verwendung von 3 M GuHCl für optimale Regenerationsbedingungen, da dieser Puffer bei allen Testproteinen zu den besten Regenerationsergebnissen führte. Je nach Zielprotein können jedoch auch andere Puffer verwendet werden.
StrepMAB-Immo
Aufgrund der nahezu irreversiblen Bindung von Strep-tag®II-Proteinen kann StrepMAB-Immo als Alternative zu Strep-Tactin®XT für die SPR-Analyse verwendet werden. Das Beispiel zeigt die stabile Bindung eines Strep-tag®II Fusionsproteins auf einem mit StrepMAB-Immo beschichteten SPR-Chip.

Chips für SPR wurden entweder mit StrepMAB-Immo oder mit einem kompetitiven Antikörper (Competitor Q) beschichtet. Anschließend wurde ein Strep-tag®II-Fusionsprotein eingefangen, und die Bindungsstabilität wurde mit einem Biacore 3000 bestimmt.
Während der Waschphase bleibt das rekombinante Strep-tag®-Protein von Interesse fest an StrepMAB-Immo gebunden, während eine erhebliche Menge des Strep-tag®-Proteins mit dem kompetitiven Antikörper ausgewaschen wird.

