Immunhistochemie und Immunozytochemie
Unter den Immunfärbemethoden ist die Immunhistochemie die bekannteste, bei der ganze Gewebe sichtbar gemacht werden können und somit spezifische Zielproteine nachgewiesen werden können. Im Gegensatz zur Immunhistochemie liegt bei der Immunzytochemie der Schwerpunkt nicht auf Geweben, sondern auf Zellen. Der Vorteil beider Techniken ist die Möglichkeit, Proteine in ihrem richtigen histologischen Kontext abzubilden, was die Lokalisierung in bestimmten zellulären Kompartimenten ermöglicht und mit Fluoreszenzmikroskopie nachgewiesen werden kann. Bei beiden Methoden ist die Fixierung der Probe unerlässlich, um die Morphologie und Struktur zu erhalten.
Für die Detektion werden sowohl chromogene als auch fluoreszierende Markierungen verwendet, wobei die Fluoreszenzmarkierung aufgrund der Möglichkeit der Mehrfachfärbung verschiedener Zielproteine besonders beliebt ist. StrepMAB-Classic oder StrepMAB-Immo, die mit verschiedenen Farbstoffen konjugiert sind, können für die direkte Detektion von Strep-getaggteg Zielproteinen verwendet werden. Als Alternative zu Antikörpern können auch Strep-Tactin® und Strep-Tactin® XT mit verschiedenen fluoreszierenden Konjugaten verwendet werden. Aufgrund ihrer starken und hochspezifischen Interkation mit Strep-getaggten Zielproteinen erzeugen beide Signale mit hoher Sensitivität, so dass kein sekundärer Antikörper erforderlich ist. Wenn jedoch nur geringe Mengen an Strep-getaggtem Protein vorhanden sind, können die unkonjugierten murinen Antikörper StrepMAB-Classic und StrepMAB-Immo in Kombination mit einem sekundären Antikörper nach Wahl verwendet werden.
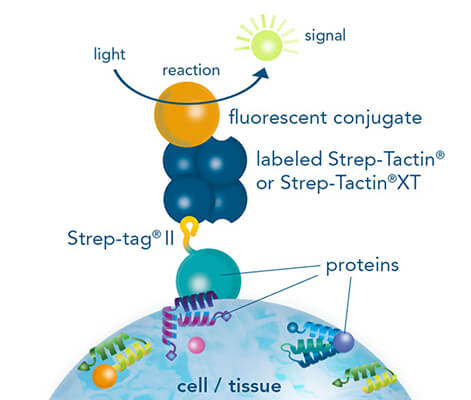
Immunhistochemie/-zytochemie mit fluoreszenzmarkiertem Strep-Tactin®
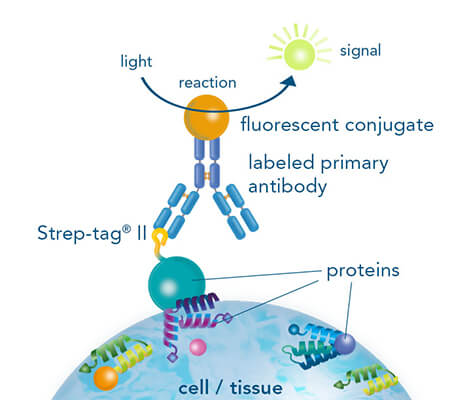
Immunhistochemie/-zytochemie mit fluoreszenzmarkiertem StrepMAB-Antikörper
Anwendungsbeispiel
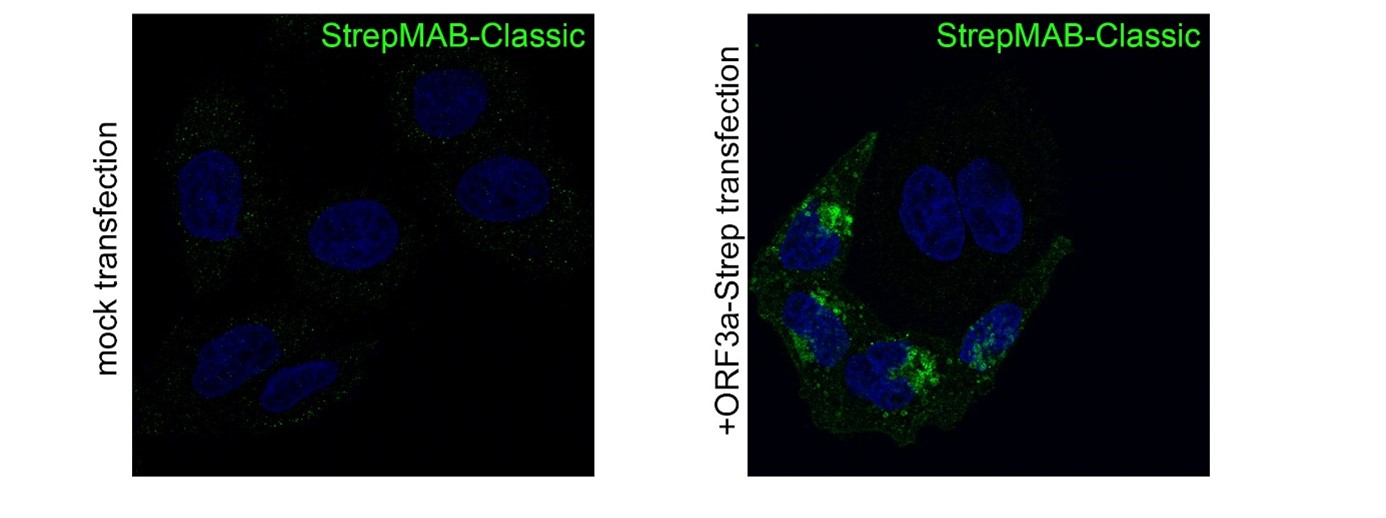
StrepMAB-Classic
Anwendung: Konfokalmikroskopie (Immunofluoreszenz)
Verdünnung: 1:500
HeLa-Zellen wurden auf Deckgläsern gezüchtet, fixiert (4% PFA/PBS), gequencht (15 mM Glycin/PBS), permeabilisiert (0,1% Saponin/PBS), blockiert (1% BSA, 0,01% Saponin in PBS) und mit StrepMAB-Classic (1:500) angefärbt, um die Expression von SARS-CoV-2 ORF3a-Twin-Strep-tag zu bestätigen. Als Sekundärantikörper wurde anti-Maus 488 verwendet. Die Zellkerne wurden mit DAPI angefärbt und die Bildgebung erfolgte mit einem Konfokalmikroskop LSM700 (63×/1,4 NA Ölimmersionsobjektiv; ZEISS). Quelle: die Daten wurden freundlicherweise von James Edgar, Abteilung für Pathologie an der Universität Cambridge, zur Verfügung gestellt.

