Bio-Layer-Interferometrie
Die Bio-Layer-Interferometrie (BLI) ist wie SPR eine markierungsfreie optische Biosensortechnologie zur Analyse biomolekularer Interaktionen, z. B. von Antigen-Antikörper-Interaktionen, in Echtzeit und ermöglicht die Quantifizierung ihrer Bindungsstärke und -kinetik. Bei BLI-Experimenten werden dünne Nadeln, so genannte Biosensoren, an der Spitze mit einem gewünschten Liganden gekoppelt und in eine Probe mit Analyten getaucht. Um zu bestimmen, ob der Analyt an den Liganden gebunden ist, wird weißes Licht durch den Biosensor geleitet und das von der Oberfläche der Spitze reflektierte Licht gemessen. Wenn der Ligand mit dem Analyten interagiert, ist die Schicht auf der Oberfläche der Spitze dicker als der Ligand allein, was zu einer anderen Wellenlänge führt, die reflektiert wird. Das BLI-Gerät (Octet® oder Gator®) misst sowohl das reflektierte Licht des Liganden allein als auch das des Ligand-Analyt-Komplexes. Die Wellenlängenverschiebung zwischen beiden Reflexionsmustern erzeugt ein Interferenzmuster, das anschließend zur Berechnung der Bindungsstärke und -kinetik verwendet wird.
Doch wie bindet man den Liganden am besten an die Oberfläche des Biosensors? Im Prinzip kann der Ligand direkt über chemische Kopplungsmethoden wie EDC/s-NHS-Kopplung gebunden werden. Dies erfordert jedoch Zeit, um die optimalen Reaktionsbedingungen zu finden, und kann die Aktivität des Liganden verringern. Darüber hinaus kann die Ausrichtung des Liganden variieren, was die Zugänglichkeit für den Analyten verringern und zu uneinheitlichen Messergebnissen zwischen den Biosensoren führen kann.
Diese Nachteile können vermieden werden, wenn eine indirekte Bindung über die Strep-tag-Technologie verwendet wird. Anstelle des Liganden wird zunächst Strep-Tactin®XT auf dem Biosensor immobilisiert und der mit dem Twin-Strep-tag-getaggte Ligand anschließend von diesem eingefangen. Da sich der Tag an einer definierten Position befindet, werden alle Proteine (Liganden), die von Strep-Tactin®XT eingefangen werden, in der gleichen Orientierung dargestellt. Darüber hinaus ermöglicht die pM-Affinität von Strep-Tactin®XT für den Twin-Strep-tag® die spezifische Erfassung von Twin-Strep-tag-getaggten Proteinen aus komplexen Proben, z. B. Kulturüberständen, und führt zu zuverlässigen und robusten Daten. Alle Reagenzien, die für die schnelle und einfache Beschichtung von Strep-Tactin®XT-Biosensoren erforderlich sind, sind in unserem Strep-Tactin®XT BLI Coupling Kit enthalten, und gebrauchsfertige Strep-Tactin®XT-Biosensoren werden von Gator® bereitgestellt.
Diese Applikationsbericht zeigt, wie die Strep-Tactin®XT-Technologie in Kombination mit BLI- und SPR-Analysegeräten eingesetzt werden kann.
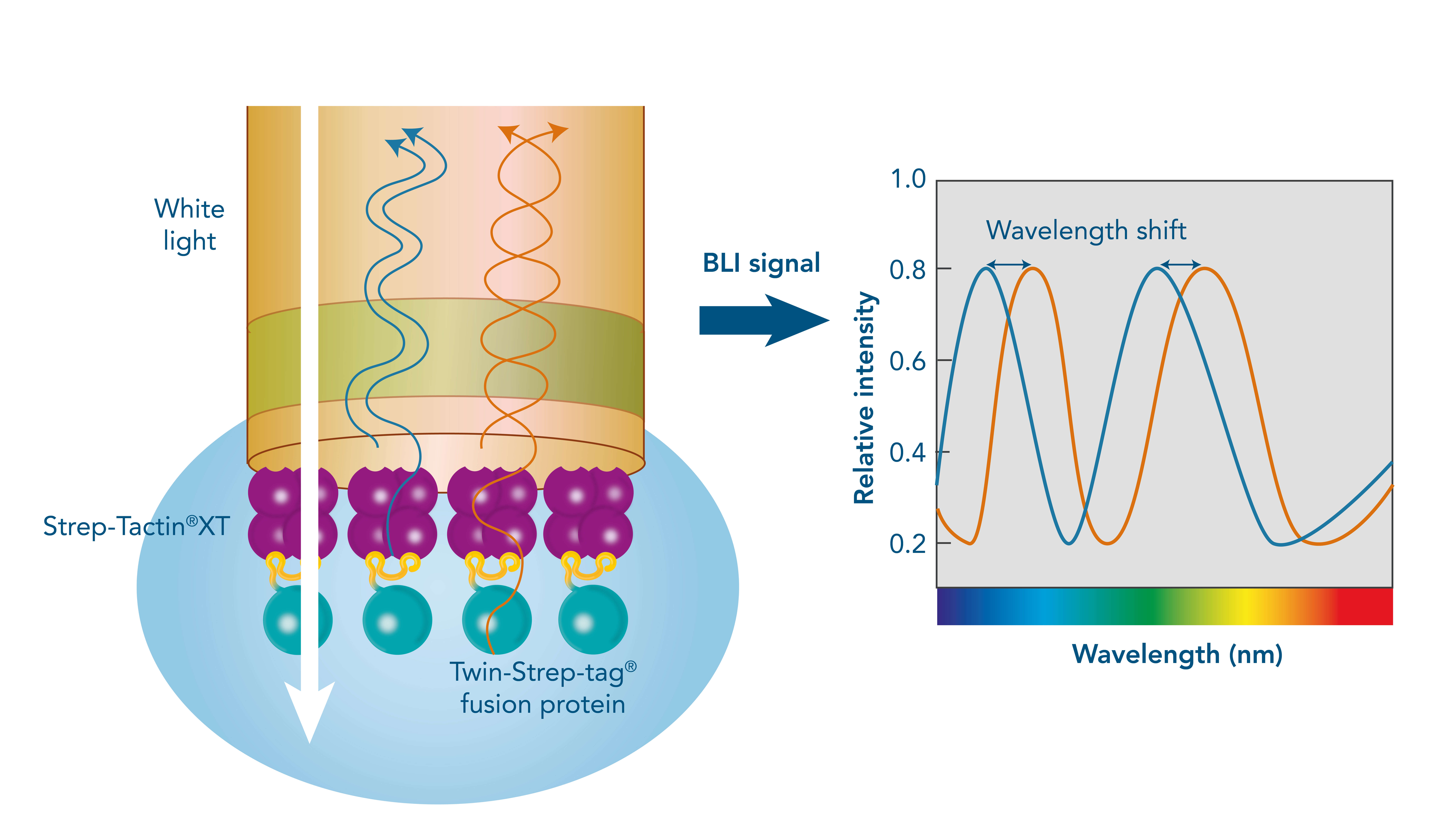
Bio-Layer-Interferometrie (BLI) in Kombination mit Strep-Tactin®XT für die uniforme und spezifische Immobilisierung von Twin-Strep-tag-Fusionsproteinen.
Quantifizierung und kinetische Analyse von Twin-Strep-tag-Fusionsproteinen
Der Twin-Strep-tag® wird häufig zur Reinigung rekombinanter Proteine in Bereichen wie Strukturbiologie, Enzym-Engineering und Proteincharakterisierung eingesetzt. Seine hochspezifischen Bindungseigenschaften ermöglichen eine effiziente Reinigung von Zielproteinen mit hoher Reinheit. Der Twin-Strep-tag® ist gegenüber dem His-Tag besonders vorteilhaft für Proteine, die bei physiologischem pH gereinigt werden müssen, um ihre Funktionalität zu erhalten.
Gator® Strep-Tactin®XT-Biosensoren
Gators Strep-Tactin XT-Sonden sind speziell für die Immobilisierung von Twin-Strep-tag-getaggten Proteinen konzipiert. Die Sonden sind mit Strep-Tactin®XT beschichtet, das mit picomolarer (pM) Affinität den Twin-Strep-tag® (TST) bindet. Die Strep-Tactin XT-Sonde ist besonders geeignet für die Quantifizierung und kinetische Charakterisierung von TST-getaggten Proteinen.
Webinar
Dieses Webinar beschreibt, wie Strep-Tactin®XT zur effizienten Reinigung von in Säugetierzellen produzierten Nanobodies eingesetzt werden kann und wie Strep-Tactin XT-Biosensoren zur Analyse der Nanobodies mittels BLI verwendet werden können.

