MEXi Mammalia Expressionssystem
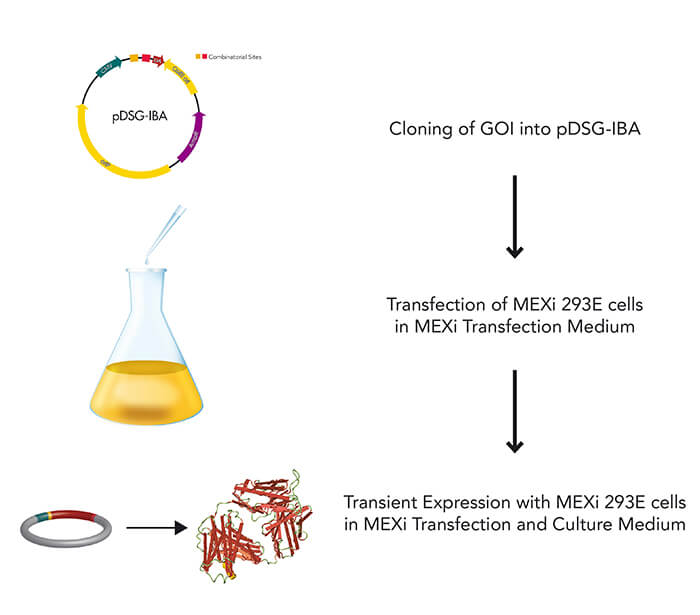
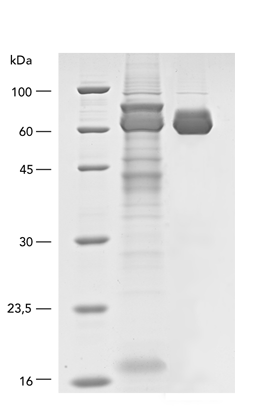
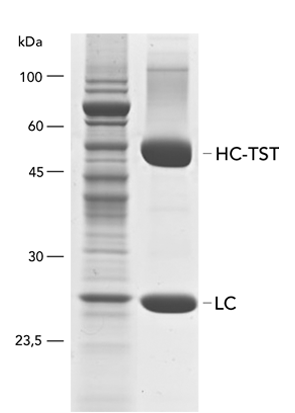
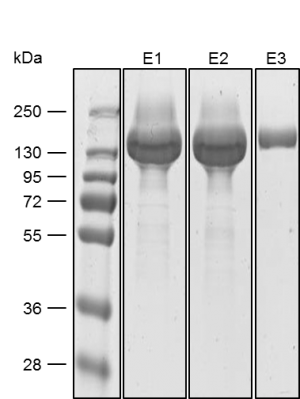
Säugetierzellen werden häufig für die Expression rekombinanter Proteine verwendet, wenn eine komplexe Glykolyse und eine genaue Proteinfaltung wichtig sind. Das MEXi-System bietet ein erschwingliches Mammalia Expressionssystem mit allen wesentlichen Komponenten. MEXi-293E-Zellen sind humane embryonale Nierenzellen (HEK-Zellen), die von der 293-Zelllinie abgeleitet und für das Suspensionswachstum in einem kostengünstigen Zellkulturmedium mit niedrigem Biotingehalt angepasst sind. Dies ermöglicht eine hocheffiziente und spezifische Aufreinigung von rekombinanten Proteinen über Strep-Tactin®XT unter physiologischen Bedingungen.
Das MEXi-System nutzt die transiente Expression anstelle der stabilen Transformation, um eine schnelle und kurzfristige Produktion des rekombinanten Proteins über mehrere Tage nach der DNA-Transfektion zu ermöglichen. Dies geschieht durch episomale Replikation und Expression des eingebrachten Gens ohne vorherige Integration, indem das EBNA1-Protein in Kombination mit oriP-tragenden Plasmiden verwendet wird. Darüber hinaus nutzt das System eine Transfektion auf Polyethylenimin-Basis, eine kostengünstige und schnelle Methode, die auch für schwer zu transfizierende Zelllinien geeignet ist und gleichzeitig zytotoxische Effekte wie bei lipidbasierten Techniken oder eine komplizierte virale Hülle vermeidet. IBA Lifesciences bietet Produkte an, die über die Proteinexpression und -reinigung hinausgehen, wie z.B. Reagenzien für den spezifischen Nachweis mit Hilfe der Strep-tag®-Technologie. So kann die gesamte Forschungsaufgabe mit synchronisierten Protokollen innerhalb einer Technologieplattform einfach durchgeführt werden.